利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
①B与醋酸反应:_____________________________________,_________________反应。
②B→C:___________________________________________,_________________反应。
(2)可用于检验A的试剂是_________________________________________。
下图所示物质(部分产物和反应条件未标出)中,只有A是单质,常温下B和C呈气态,且B是导致酸雨的大气污染物,D是氧化物,W是淡黄色固体。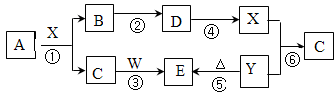
据此回答下列问题:
(1)B、C、D的化学式分别为:B、C、D;从物质分类角度,上图所给物质中属于钠盐的是(填写化学式)。
(2)上图所给物质在6个反应中只做还原剂的有(填写化学式)。
(3)上图反应中不属于氧化还原反应的有(填写序号)。
(4)写出A和X反应的化学方程式;若生成的B在标准状况下的体积为22.4L,则参加反应的A的物质的量为,反应中转移的电子数目为。
(5)请写出C和W反应的化学方程式:。
(6)请写出X和 Y反应的离子方程式:。
现要配制500mL2.0mol/L的NaOH溶液,请填写下列空白:
(1)若用固体NaOH作溶质,需NaOH的质量为 ,称取这些NaOH常用的仪器有;
(2)若用10mol/L的NaOH溶液作溶质,需NaOH溶液的体积为,量取该NaOH溶液常用的的仪器有;
(3)从上述配制的溶液中取出10mL,其中NaOH的物质的量浓度为,含有NaOH的质量为;
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为。
某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解,再加热还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是,一定没有的阳离子是。还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称),现象是。
某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。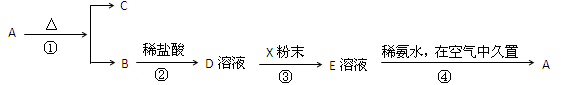
(1)请写出下列物质的化学式:A、C。
(2)在①②③④各步反应中属于氧化还原反应的有(填序号)。
(3)请分别写出反应①的化学方程式和反应③的离子方程式:①、③。
有A、B、C、D四种含硅元素的物质,它们能发生如下反应:
①C与烧碱反应生成A和水;②A溶液与钙盐溶液反应生成白色沉淀D;
③B在空气中燃烧生成C;④C在高温下与碳反应生成单质B。
根据上述变化,完成下列问题:
(1)写出B、D的化学式:B、D。
(2)写出C与烧碱反应的化学方程式:。
写出A溶液与钙盐溶液反应的离子方程式:。