某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 |
Cl- CO32- NO3- SO42- SiO32- I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)在100mlHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大(反应前后溶液体积变化忽略不计),则H2SO4和HNO3两种酸的物质的量浓度之比为 。
已知有以下物质相互转化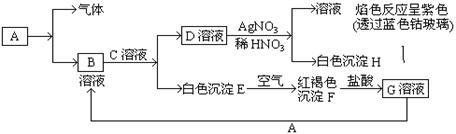
试回答:(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出F转化成G的离子方程式;
(8分)以 ①2NaOH+ Cl2 NaCl+NaClO+H2O② 2Na + Cl2
NaCl+NaClO+H2O② 2Na + Cl2 2NaCl
2NaCl
③ 2Fe3+ + 2I– 2Fe2+ + I2 ④ 2Fe2+ + Br2
2Fe2+ + I2 ④ 2Fe2+ + Br2 2Fe3+ + 2Br–
2Fe3+ + 2Br–
这四个反应为例,我们来探究氧化还原反应。
(1)氧化还原反应的本质是。
(2)对于反应①,氧化剂是。
(3)对于反应②,Na的化合价由0价变成+1价,化合价升高的原因是。
(4)由③、④两反应,可以推断Fe3+、Br2、I2的氧化性强弱顺序为。
(1)鉴别KCl溶液和K2CO3的试剂是 ,离子方程式为 。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是 ,离子方程式为 。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。(3分)
A、B是中学化学里常见的物质,其中B是单质,A是化合物。各物质之间的转化关系如图所示: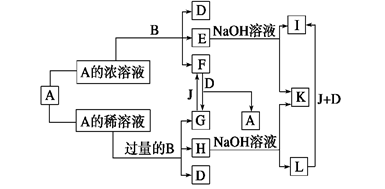
已知:往E溶液中滴加KSCN溶液时,溶液呈红色; A的浓溶液与B在常温下无明显反应现象。请回答:
(1)框图中B和A的浓溶液反应的条件是,而常温下无明显现象的原因是 _________ ____________________________________________ ;
(2)写出F和G相互转化的化学方程式:
F→G:;
G→F: __________ ;
(3)L转化成I的化学方程式是_____________________________________________。
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示:
由此可知,(1)该溶液中肯定含有的阳离子是____________________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是___________;检验可能含有的某种阳离子的常用实验方法是;
(2)分别写出BC、CD段对应的离子方程式,并写出BC段参加反应的阳离子在实验室中常用的检验其存在的方法:BC:________________________________________;
检验:_____________________________________________;
CD:__________________________________________.