W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z单质的氧化性在同周期主族元素中最强。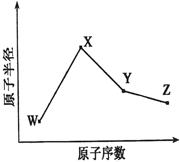
(1)X位于元素周期表中第 周期第 族;
(2)X的单质和Y的单质相比,熔点较高的是 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 。
(4)写出Z的单质与甲烷在光照的条件下发生第一步反应的方程式 。
(10分)
苯佐卡因可用于粘膜溃疡、创面等的镇痛,是一种常用的局部麻醉剂,其合成路线如下图所示: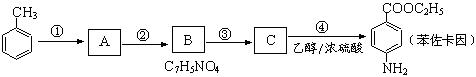
已 知:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。
知:①当苯环上连有甲基时,再引入的其他基团主要进入甲基的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入羧基的间位。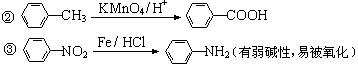
请回答下列问题:
(1)上述合成路线中属于取代反应的是 (填代号)。
化合物C 中含有的含氧官能团的名称为 。
中含有的含氧官能团的名称为 。
(2)合成路线中反应①的化学方程式为 。
(3)下列关于上述合成路线的说法中正确的是 。(填字母)
a.反应①除主要生成物质A外,还可能生成 、
、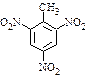 等
等
b.步骤①和②可以互换c.反应③是还原反应
(4)苯佐卡因有多种同分异构体,请写出其中任意一种满足下列条件的同分异构体的结构简式: 。
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。
(5)化合物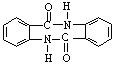 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图。
提示:① 合成过程中无机试剂任选;②合成路线流程图示例如下:
合成过程中无机试剂任选;②合成路线流程图示例如下:
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)CH3+、·CH3、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们的空间构型相同,碳原子均可以采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp3杂化,所有原子均共面 |
(2)在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
①HCl、CS2、H2S、SO2四种分子中 μ=0的是;
μ=0的是;
②实验测得:μPF3=1.03、μBCl3=0。由此可知,PF3分子是构型,BCl3分子是构型。
(3) 对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中
对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中 ,适合作录音带磁粉原料的是__________________。
,适合作录音带磁粉原料的是__________________。
(4)利用光电子能谱证实:在洁净铁(可用于合成氨
反应的催化剂)的表面上存在氮原子,右图为氮原子在
铁的晶面上的单层附着局部示意图(图中小黑色球代表
氮原子,灰色球代表铁原子)。则在单层晶面上N/Fe原
子数之比为________________。
(5)金属晶体的结构可用等径圆球的密堆积来描述,在等径圆球的最密堆积的各种形式中,立方最密堆积和六方最密堆积最为重要,请指出下图中哪个为立方最密堆积(填“A”或“B”)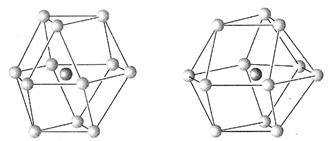
图A图B
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有、。
(2)天然水在净化处理过程中加入的混凝剂可以是其纯净水作用的原理是
(3)水的纯净和软化的区别是
(4)硬度为 的水是指每升水含10
的水是指每升水含10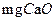 或与之相当的物质(如7.1
或与之相当的物质(如7.1 )。若某天然水中
)。若某天然水中 ,
, ,则此水的硬度为;
,则此水的硬度为;
(5)若(4)中的天然水还含有 ,现要软化10
,现要软化10 这种天然水,则需先加入
这种天然水,则需先加入
 ,后加入
,后加入
 。
。
(10分,每空2分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。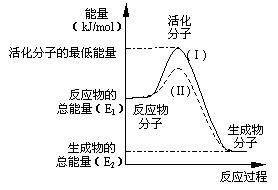
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的△H=____________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+0.5 O2(g)=H2O(g);△H=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________________。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第_______周期、第_______族;
(2)写出反应①的化学方程式____________________;
(3)写出反应④的离子方程式____________________;
(4)写出反应③的电极方程式:
阳极:___ _________________阴极:______________________
_________________阴极:______________________
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)