利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用98%(密度是1.84g/cm3)的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需___________,需要取用________ml98%(密度是1.84g/cm3)的浓硫酸.
(2)酸浸时,为了提高浸取率可采取的措施有____________________(答出两点)。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
- |
- |
- |
| 沉淀完全时的pH |
3.7 |
11.1 |
8 |
9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR―→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:_______________________。
(1)金属钠着火,_________(填“能”或“不能”)用水灭火,原因是________________________________________________________(用化学反应方程试解释);______(填“能”或“不能”)用泡沫灭火器灭火,原因是____________________________(用化学反应方程试解释)。
(2)甲型H1N1流感病毒在全球广泛传播,给人类健康、社会经济带来了巨大的负面影响。我国采取积极应对措施,使病毒得到了有效控制,从很大程度上减少了损失,在这里,消毒液功不可没。①生产消毒液是将氯气通入NaOH溶液中,发生的离子反应方程式为_____________________________________。
②消毒液稀释后喷洒在空气中,可以生成有漂白性的物质,请写出此过程的离子反应方程式_____________________________________;该物质有漂白性是因为它有强氧化性,但是它很不稳定,请写出它分解的化学方程式_____________________________________。
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+ 转变为易吸收的Fe2+,,这说明维生素C具有[(填“氧化性”或“还原性”)
(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时的反应为:S+2KNO3 +3C=K2S+N2↑+3CO2↑.该反应中还原剂是,氧化剂是。
+3C=K2S+N2↑+3CO2↑.该反应中还原剂是,氧化剂是。
有一包粉末状固体,可能是由Al2(SO4)3、CuCl2、KNO3、Na2O中的一种或几种组成的。为了探究它的成分,某学习小组做了如下实验。
①取适量粉末投入蒸馏水中,粉末完全溶解,得到蓝色透明溶液A。
②取A溶液少量,向其中逐滴滴加烧碱溶液直到过量,观察到先有沉淀出现,而后沉淀逐渐增多,然后沉淀又逐渐减少,但最终仍有部分蓝色沉淀。
③再取A溶液两份,一份滴加BaCl2溶液后,出现白色沉淀;另一份滴加硝酸银溶液后也出现白色沉淀。请回答下列问题:
(1)原白色粉末一定含有 ,一定不含,可能含有。(填化学式)
,一定不含,可能含有。(填化学式)
(2)写出过程②中涉及到的离子方程式: 。
。
(3)如果要进一步确定可能存在的物质,进行的实验操作及实验现象和结论是
。
(1)下图所示为按树状分类法对一组物质进行的分类。请填写下列标注。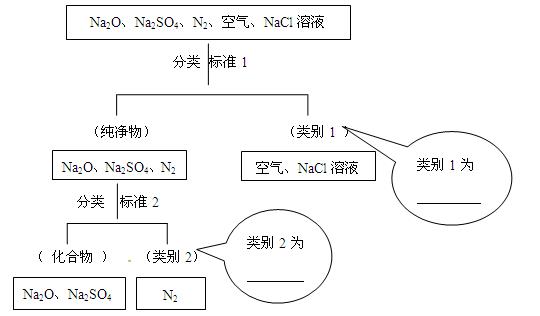
(2)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________________。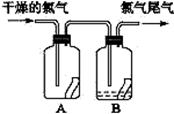
(3) 为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_________________溶液吸收多余的氯气,原理是(用化学方程式表示)__________________________________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______________________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______________________(用字母代号填)。
为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_________________溶液吸收多余的氯气,原理是(用化学方程式表示)__________________________________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______________________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______________________(用字母代号填)。
| A.O2 | B.Cl2 | C.CO2 | D.HClO |
(14分)莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一。莽草酸是A的一种异构体。A的结构简式如下:
(1)A的分子式是。
(2)A与溴的四氯化碳溶液反应生成物的结构简式是
(3)A与氢氧化钠溶液反应的化学方程式(有机物用结构简式表示)是
(4)17.4克A与足量碳酸氢钠溶液反应,计算生成二氧化碳的体积(标准状况)。(5)A在浓硫酸作用下加热可得到B(B的 结构简式为
结构简式为 ),其反应类型。
),其反应类型。
(6)B的同分异构体中既含有酚羟基又含有酯基的共有种,写出其中一种同分异构体的结构简式 。
。