(15分)(一)尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1=" -330.0" kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1=" -330.0" kJ·mol-1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=" +" 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_______(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,氨气溶于水得到氨水,在25℃下,将a mol/L的氨水与b mol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。此溶液中各离子浓度由大到小的顺序为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)  CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
| A.容器内的压强不变 |
| B.消耗水蒸气的物质的量与生成CO的物质的量相等 |
| C.混合气的密度不变 |
| D.单位时间有n个H—O键断裂的同时有n个H—H键断裂 |
②x应满足的条件是 。
迷迭香酸是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,其结构如下图所示。
某同学设计了迷迭香酸的合成线路:
已知:①
 、
、 表示烃基或氢原子;
表示烃基或氢原子;
②苯环上的羟基很难直接与羧酸发生酯化反应。
(1)迷迭香酸分子中所含官能团的名称是羟基、碳碳双键、___________和___________。
(2)A的结构简式为___________。
(3)C的结构简式为___________。
(4)D、E反应的化学方程式为______________________。
(5)与E互为同分异构体且同时满足下列条件的有机物有____种,写出其中任意两种同分异构体的结构简式:___________、__________。
①苯环上共有四个取代基,且苯环上只有一种化学环境的氢原子;
②1mol该同分异构体分别与NaHCO3、NaOH反应时,最多消耗NaHCO3、NaOH的物质的量分别是1mol、4mol。
化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧,质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3。
方法二:红外光谱仪测得A分子的红外光谱下图所示: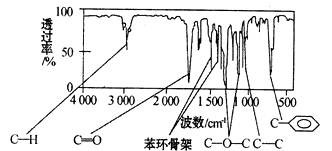
(1)A的分子式为________________。
(2)已知:A分子中只含一个苯环,且苯环上只有一个取代基,A可以水解,写出符合上述条件的A的结构简式________________(只写一种)。
(3)此A在无机酸作用下水解的化学方程式为________________。
以五倍子为原料可制得A,A结构简式为下图所示,回答下列问题:
(1)A的分子式为_______________。
(2)有机化合物B在硫酸催化条件下加热发生酯化可得到A。写出B的结构简式为____________。
(3)写出A与过量NaOH溶液反应的化学方程式_____________________。
提纯下列物质(括号内为杂质),填写所选用的除杂试剂和除杂方法
| 括号内为杂质 |
除杂试剂 |
操作 |
|
| 1 |
乙烷(乙烯) |
||
| 2 |
乙酸乙酯(乙酸) |
||
| 3 |
苯(苯酚) |
||
| 4 |
乙醇(水) |
写出下列化学方程式,并标注反应类型
(1)苯酚与浓溴水反应______________________,反应类型__________________。
(2)由氯乙烯制取聚氯乙烯___________________,反应类型__________________。
(3)乙醛发生银镜反应______________________,反应类型_____________________。