为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下: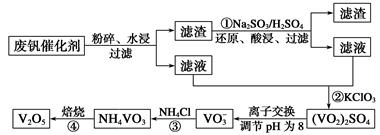
部分含钒物质在水中的溶解性如下:
| 物质 |
VOSO4 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
| 溶解性 |
可溶 |
难溶 |
难溶 |
易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵图中所示滤液中含钒的主要成分为 (写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。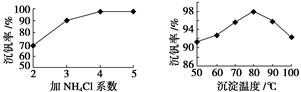
⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式为□VO2++□H2C2O4+□_____=□VO2++□CO2↑+□H2O。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+ 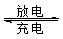 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
下图是CH2=CH—CH=CH2合成D(OHC—CH=CH—CHO)的流程。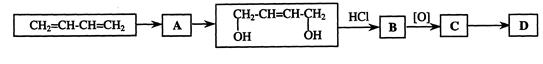
回答下列问题:
(1)若A为溴代物写出其结构简式 。
(2)写出B C反应的化学方程式 。
C反应的化学方程式 。
(3)写出C D的反应类型 。
D的反应类型 。
(4)已知CH2=CH—CH=CH2+CH2=CH2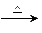
 ,请写出CH2=CH—CH=CH2两分子加成后的产物 。
,请写出CH2=CH—CH=CH2两分子加成后的产物 。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为 。
(2)A与溴的四氯化碳溶液反应的化学方程式为 ,反应类型是 ;
(3)已知: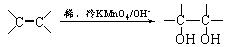 。请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得的产物 ;
。请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得的产物 ;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式 ;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为 。
(Ⅰ)某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如下:
请填写下列空白:
(1)A的化学式是 。
(2)振荡的目的是 。
(3)分液操作需要的玻璃仪器有 。
(4)写出水层中有关物质与A气体反应生成苯酚的化学方程式: 。
(Ⅱ)甲苯和溴乙烷混合物可通过如下流程进行分离。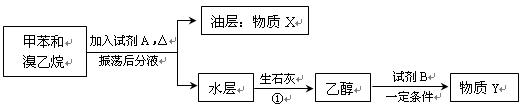
请填写下列空白:
(1)试剂A的名称为 。
(2)写出在甲苯与溴乙烷的混合物中加入试剂A时发生反应的化学方程式: 。
已知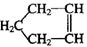 可简写为
可简写为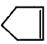
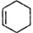
Ⅰ.降冰片烯的分子结构可表示为: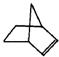
(1)降冰片烯属于__________。
a.环烷烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯不具有的性质__________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
Ⅱ.利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为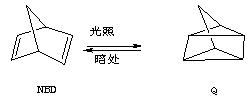
(1)NBD有多种同分异构体,其中属芳香烃的只有一种,其结构简式为,系统命名为。
(2)四环烷(Q)一氯代物共有种。
影响化反应速率的因素很多,某校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响化学反应速率的因素。
甲同学的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积2mol/L的硫酸于试管中 ②___________________ |
反应速率Fe>Mg,Cu反应 |
金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________;
(2)甲同学的实验目的是_________________________;要得出正确的实验结论,还需要控制实验的条件是_____________________________;
乙同学为了更精确地研究浓度对反应速率的影响,
利用右图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是_________________________;
(4)乙同学完成该实验应选用的实验药品是_________________________。