请你帮助小林同学完成“探究碱式碳酸铜(铜绿)的性质”实验的报告:
[实验目的]探究铜绿的性质
[实验用品]略
[实验过程及现象记录]
(1)观察铜绿的颜色和状态等物理性质:铜绿是绿色粉末状固体。
(2)用药匙或纸槽分别取少量铜绿于两支试管中
(3)然后用胶头滴管向其中一支试管中逐滴滴加稀盐酸,观察到铜绿逐渐溶解,产生大量_____,并形成蓝色溶液
(4)将另一支试管在酒精灯上加热,一段时间后,观察到固体粉末逐渐变成____色,且试管壁有水雾出现,若把产生的气体通入澄清石灰水中,石灰水会变浑浊。
[实验结论]铜绿具有的化学性质是:
(1)铜绿能与_____________反应;
(2)铜绿受热易分解,由分解的产物可推断出铜绿是铜在空气中与______、_______、_______等发生复杂的化学变化生成的。
呼吸面具中的“氧气再生剂”,主要成分是淡黄色固体过氧化钠(Na2O2),使用后变成白色固体。某兴趣小组对白色固体的成分进行了探究。
【作出猜想】根据呼出的气体中含有较多的 和 ,作出如下猜想:
猜想一:白色固体中一定含有氢氧化钠
猜想二:白色固体中一定含有碳酸钠
猜想三:白色固体中一定含有氢氧化钠和碳酸钠
【实验验证】
(1)小明取少量水溶解白色固体,然后滴加酚酞溶液,溶液变红色。于是小明认为猜想二一定不正确。同学们认为小明的实验不能得出正确结论,因为 。
(2)小红另取少量白色固体,滴加少量稀盐酸,没有观察到有气泡产生,于是小红认为白色固体中一定不含有碳酸钠,并得出结论只有猜想一正确,猜想二和猜想三都不正确。同学们认为小红的实验也不能得出正确结论,因为 。
(3)小玉另取少量白色固体用适量的水溶解。依次滴加足量的氯化钙溶液、少量的硫酸铜溶液进行试验,依次观察到产生 和 ,证明猜想三成立。小玉为什么用氯化钙溶液而不用澄清的石灰水呢? 。
【拓展应用】“氧气再生剂”的保持方法是 。
小明家有包开启了的小苏打,久置在灶台上方,可能因受热而变质。小明为此开展了探究,请分析其过程完成填空。
【查阅资料】①2NaHCO3 Na2CO3+ CO2 ↑ + H2O
Na2CO3+ CO2 ↑ + H2O
②2NaHCO3+ Ca(OH)2= CaCO3 ↓ + Na2CO3+ 2H2O
③Na2CO3受热不分解,NaHCO3能溶与水。
【假设猜想】 假设一:小苏打没有变质,化学成分为 NaHCO3;
假设二:小苏打完全变质,化学成分为;
假设三:小苏打部分变质,化学成分为。
【实验方案】(实验现象2分)
可选药品:①Ca(OH)2溶液 ②CaCl2溶液 ③NaOH溶液 ④稀盐酸
| 实验操作 |
实验现象 |
实验结论 |
| 操作一:取小苏打样品少量溶于足量水后,加入过量的(填药品编号,下同),观察,如有沉淀,则继续进行下一步操作。 操作二:待操作一中反应充分后过滤,并在滤液中加入过量的,观察。 |
操作一中无沉淀出现 |
假设一成立 |
| 假设二成立 |
||
| 假设三成立 |
【问题讨论】有同学认为,取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断。请评价这种方案是否合理(填“是”或“否”),理由是。
研究性学习小组甲对教材实验结论“葡萄糖与新制氢氧化铜反应生成的红色沉淀是氧化亚铜(Cu2O),提出质疑,他们认为红色沉淀不一定全是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:
提出猜想:红色沉淀可能是①Cu2O。②Cu2O和Cu
查阅资料:①氧化亚铜能与酸反应,得到+2价的铜盐和单质铜;
②在空气中灼烧氧化亚铜生成氧化铜;
研究性学习小组甲设计出三种方案来验证猜想
方案1:取该红色沉淀加入稀盐酸中,观察溶液是否变蓝;
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣;
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次直到固体恒重,称得质量为b g,比较a,b关系;
(1)葡萄糖的化学式为,属于(填”有机物”或”无机物”),检验葡萄糖用的新制氢氧化铜由硫酸铜溶液与氢氧化钠溶液反应生成,反应的化学方程式为
(2)根据查阅资料,写出氧化亚铜与稀硫酸的反应方程式。
研究性学习小组甲设计出三种方案你认为合理的方案是 。
研究性学习小组乙设计新的探究方案探究红色沉淀成份,装置如下图所示。
已知①2NH3+3Cu2O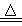 N2+6Cu+3H2O
N2+6Cu+3H2O
②浓氨水与固体CaO接触,会逸出大量氨气, 碱石灰是氧化钙和氢氧化钠的混合物可吸收水和二氧化碳
方案如下(1)连好装置,检查装置气密性
(2)准确称取28.8克的红色沉淀于玻璃管中
(3)先A处反应,通一段时间氨气后称量D质量为108.3克,
(4)加热装置C
(5)待D中恒重为111.9克时,停止加热,继续通氨气直到装置C完全冷却.

(3)A处为用浓氨水与固体CaO接触,以产生稳定持续的氨气,则A处的发生装置应选(填”甲”,”乙”或”丙”),,
(4)B中碱石灰的作用是________________,加热前先通氨气的目的除了消除掉原来空气的的二氧化碳和水蒸汽对实验结果影响,还具有一个作用为.
停止加热,继续通氨气除了让生成的铜充分冷却,还有的一个作用为。
(5)为防止未反应的氨气扩散到空气中,E处可以连接的装置为(液体均为稀硫酸,从下列选项中选择)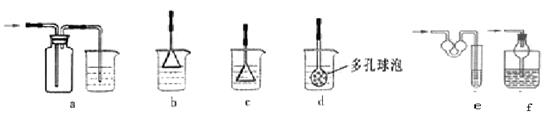
(6)红色沉淀的成份为(通过计算说明共2分)
(7)有同学认为利用此实验装置还可以测定水中氢.氧元素的质量比,不过还需要测出一个数据,你认为要测出的数据为(从下列选项中选择),
A.实验所消耗的氨气质量
B.B中干燥管中增加的质量
C.完全反应后玻璃管中固体质量
(8)下列情况会使测定水中氢、氧元素的质量比偏小的有 (从下列选项中选择)
A.红色沉淀未完全反应 B.红色沉淀未完全干燥
C.实验中缺少B装置 D.实验结束后未等铜完全冷却就拆除装置
如图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题.
该钙片主要成分碳酸钙,碳酸钙的相对分子质量为 ①.
某校化学兴趣小组为了确认标签中碳酸钙的含量是否真实,决定通过实验进行探究.
实验目标:测定该钙片主要成分碳酸钙的含量.
实验原理:取一定质量的钙片与足量的稀盐酸反应,测量生成的CO2的质量(已知该状态下CO2的密度),然后计算其中碳元素的质量,利用反应前后碳元素的质量不变,再计算出碳酸钙的质量.
实验方案:兴趣小组的同学们经过思考提出了以下几种实验方案,请你参与他们对实验方案的讨论、取舍.
方案一:甲同学设计了如图所示的装置,通过反应后右侧注射器(注射器最大量程为20mL)内收集到气体的量来进行计算.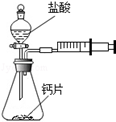
(1)同学们观看了他的设计后,都认为该方案中样品的取用的量需要一定的控制,这是因为.
(2)同学们讨论后,一致认为注射器的摩擦会影响生成的CO2的完全收集.
方案二:乙同学设计了如图所示的装置,与甲同学的相比,仅仅在收集方法上不同.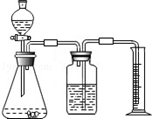
(1)同学们观看了他的设计后,都认为所测得CO2气体的体积将会 ①(填偏大或偏小),你认为他们的理由是 ②,你的改进方案是 ③;广口瓶内原有的空气对实验结果 ④(填“有”或“没有”)影响.
(2)同学们讨论后,一致认为把装置改进后测得生成的CO2气体体积会偏大,你认为他们的最主要理由是.
方案三:丙同学设计了如图所示的装置.同学们观看后一致认可他的设计,并按照他的思路设计了以下实验步骤.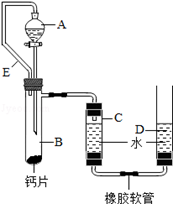
实验步骤:
①连接装置并检查装置气密性;
②加入10片钙片和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加稀盐酸至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥计算气体的质量.
实验反思:
(1)丙同学在实验前将钙片全磨成粉末状,你认为他的目的是:;
(2)检查该装置的气密性时,如图准备好装置,在C、D两管中装好水且液面相平,提高D管,,则气密性良好;
(3)实验结论:经多次实验(钙片都是10片),所得CO2气体的平均质量是6.82g,请你最后计算确认标签中碳酸钙的含量是(填“真实”或“不真实”)的.(最后一空不需要写计算过程)
某校兴趣小组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中(如下图),有一装溶液的试剂瓶未盖瓶盖且标签破损,于是决定对这瓶溶液进行实验探究: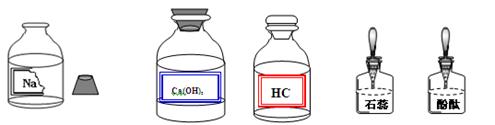
【提出问题】这瓶溶液是什么溶液?
【获得信息】实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】这瓶溶液是:
猜想一:氯化钠溶液;
猜想二:氢氧化钠溶液;
猜想三:碳酸钠溶液。
【实验推断】
(1)小丽取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是溶液,理由是;
(2)小刚另取样滴加稀盐酸有产生,反应的化学方程式为,小刚得出结论:该溶液是碳酸钠溶液。
(3)小青认为小刚的结论不完全正确,理由是。小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有产生,设计这一步骤的目的是;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液是。
【探究启示】实验取完药品后应。
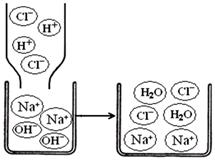
【拓展迁移】若氢氧化钠溶液与盐酸发生中和反应,恰好完全反应的微观过程如图所示,反应的实质表达式为:H+ + OH- = H2O,则反应后溶液中存在的阴、阳离子是、(填离子符号);请写出【继续探究】实验中加CaCl2溶液反应的实质表达式:(仿照上例,用离子符号表示。)