把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应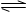 3X(g)+Y(g) nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为 ( )
3X(g)+Y(g) nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为 ( )
A.1 B.2 C.3 D.4
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0-6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水作用。其原理如图所示。下列说法正确的是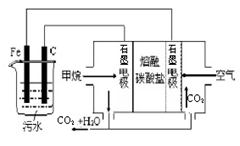
| A.铁电极为阳极,反应式为:Fe-3e-= Fe3+ |
| B.通入甲烷的石墨电极作负极,反应式为:CH4+8OH--8e-=CO2+6H2O |
| C.为增强污水的导电能力,可向污水中加入适量乙醇 |
| D.若阴极产生了44.8L气体,则理论上消耗同条件下的甲烷为11.2L |
反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1︰5 |
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是
| A.a点对应的无色溶液中能大量存在:Fe3+、Na+、Cl-、SO42- |
| B.b点对应的溶液中能大量存在:NH4+、Ca2+、AlO2-、I- |
| C.c点对应的溶液中能大量存在:Na+、Ba2+、Cl-、CO32- |
| D.d点对应的溶液中能大量存在:Na+、K+、SO32-、Cl- |
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,正确的是
A.BaSO4悬浊液中存在平衡:BaSO4(aq) Ba2+(aq)+SO42-(aq) Ba2+(aq)+SO42-(aq) |
B.向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72-+H2O 2CrO42-+2H+ 2CrO42-+2H+ |
| C.等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:Al3++2SO42-+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
D.铝热反应的原理为:Al2O3+2Fe 2Al+Fe2O3 2Al+Fe2O3 |
下列说法正确的是
| A.向蛋白质溶液中加入硫酸铵溶液,将得到的沉淀分离出来,再加水可重新溶解 |
| B.蛋白质、葡萄糖和脂肪都可以在人体中发生水解 |
| C.用氯气与乙烷混合光照获得纯净的1,2-二氯乙烷 |
| D.甲烷、乙烯和苯在工业上都通过石油分馏得到 |