溶液、胶体和浊液这三种分散系的本质区别是( )
| A.是否有丁达尔现象 | B.是否能通过滤纸 |
| C.分散质粒子直径的大小 | D.是否均一、透明、稳定 |
下列化学方程式书写错误的是
A.乙醇催化氧化制取乙醛:2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CHO+2H2O |
B.苯与浓硫酸、浓硝酸的混合液共热制硝基苯: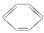 +HNO3(浓) +HNO3(浓)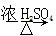 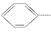 NO2+H2O NO2+H2O |
C.乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH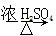 CH3COOC2H5+H2O CH3COOC2H5+H2O |
| D.乙烯使溴的四氯化碳溶液褪色: CH2CH2+Br2 CH2BrCH2Br |
下列关于有机物因果关系的叙述完全正确的一组是
| 选项 |
原因 |
结论 |
| A |
乙烯和苯都能使溴水褪色 |
苯和乙烯分子都含有碳碳双键 |
| B |
乙酸乙酯和乙烯一定条件下都能和水反应 |
两者属于同一类型的反应 |
| C |
乙酸和葡萄糖都能与新制的氢氧化铜反应 |
两者所含的官能团相同 |
| D |
乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 |
两者褪色的本质不相同 |
下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿中。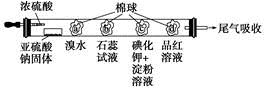
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
| 选项 |
现象 |
解释或结论 |
| A |
a处黄色褪去 |
非金属性:Br>S |
| B |
b处变为红色 |
二氧化硫与水反应生成酸性物质 |
| C |
c处变为蓝色 |
二氧化硫具有一定的氧化性 |
| D |
d处红色先褪去后恢复 |
二氧化硫具有漂白性且漂白性不稳定 |
下列说法正确的是
| A.SO2和Cl2都能使品红溶液褪色,且加热后均恢复原色 |
| B.SiO2是酸性氧化物,能与NaOH溶液反应 |
| C.紫色石蕊试液滴入SO2水溶液中,先变红后褪色 |
D.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,则该溶液中一定含有 |
下列与实验相关的叙述正确的是
| A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 |
| B.将SO2和Cl2按等物质的量比通入品红溶液中,品红很快褪色 |
| C.NO2与H2O反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为2∶1 |
D.检验某溶液是否含有 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |