某学生做浓硫酸性质的实验:在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.回答下列问题: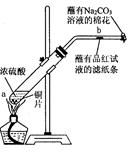
(1)写出试管中发生反应的化学方程式 。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为 ,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为 。
(3)蘸有Na2CO3溶液的棉花团作用是 。
(4)硫酸型酸雨的形成过程可用下列反应中的 来表示。
(5)浓硫酸有许多重要性质,在与含有水分的蔗糖作用过程中不能显示的性质是
| A.酸性 | B.脱水性 | C.强氧化性 | D.吸水性 |
(12分)I. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为。
(2)下列物质中,不可以通过乙烯加成反应得到的是(填序号)。
| A.CH3CH3 | B.CH3CHCl2 |
| C.CH3CH2OH | D.CH3CH2Br |
(3)已知 2CH3CHO+O2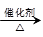 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。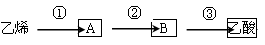
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为,反应类型是。
II. 在实验室可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇、乙酸分子中官能团的名称分别是、。
(2)试管a中发生反应的化学方程式为,反应类型是。
(3)浓H2SO4的作用是:。
(4)反应开始前,试管b中盛放的溶液是。
(8分)试用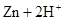 ══
══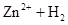 ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是;
(2)写出电极反应式:
负极:,
正极:;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
化学方程式默写
(1)单质钾与水反应
(2)乙醇与金属钠反应
(3)乙醇在铜或银做催化剂下氧化
(4)苯和液溴反应
(2分)冶炼金属的三种常用方法是:①热分解法 ②热还原剂法 ③电解法。人类用量处在前三位的金属是铁、铝、铜。(填编号)
(1)冶炼铝用到的方法是;
(2)冶炼铁和铜的常用方法是。
能源是影响经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是一种最理想的清洁能源。试填写下列空格。
(1)点燃氢气时,化学能主要转化为;
(2)氢气在原电池中反应时,化学能主要转化为 ;
(3)若在常温常压下,上述两种方式都反应1molH2,则放出的能量(填“相同”或“不相同”)。