下列实验操作中,正确的是
| A.稀释浓H2SO4时,将蒸馏水沿容器内壁缓慢倒入浓H2SO中,并及时搅拌 |
| B.测定溶液pH时,用洁净的玻璃棒蘸取待测液点在pH试纸上,观察试纸的颜色变化,并与标准比色卡相比较 |
| C.称量NaOH固体时,将NaOH固体放在垫有滤纸的托盘上 |
| D.在蒸发NaCl溶液得到NaCl晶体的实验中,必须待蒸发皿中的水分全部蒸干后才能撤去酒精灯 |
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH ( pOH = —lg c(OH- ) )与pH的变化关系如图所示,则()
| A.M点所示溶液导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO-)﹥c(Na+) |
| C.M点和N点所示溶液中水的电离程度相同 |
| D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力.CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37℃时,该反应的平衡常数K=220。若HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损.据此下列结论错误的是()
A.CO与HbO2反应的平衡常数K=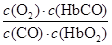 |
| B.人体吸入的CO越多,与血红蛋白结合的O2越少 |
| C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损 |
| D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动 |
醋酸是电解质,下列事实都能说明醋酸是弱电解质的组合是()
①醋酸与水能以任意比互溶②醋酸溶液能导电
③醋酸溶液中存在醋酸分子④0.1 mol/L醋酸的pH比0.1 mol/L盐酸pH大
⑤醋酸能和碳酸钙反应放出CO2⑥常温下0.1 mol/L醋酸钠溶液pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
| A.②⑥⑦ | B.③④⑤⑥ | C.③④⑥⑦ | D.①② |
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验:(N2O4 2NO2 ΔH>0)
2NO2 ΔH>0)
(a)将两容器置于沸水中加热(b)在活塞上都加2 kg的砝码
(b)在以上两情况下,甲和乙容器的体积大小的比较,正确的是()
| A.(a)甲>乙,(b)甲>乙 | B.(a)甲>乙,(b)甲=乙 |
| C.(a)甲<乙,(b)甲>乙 | D.(a)甲>乙,(b)甲<乙 |
下列各选项所述的两个量中,前者一定小于后者的是()
| A.纯水在25 ℃和100 ℃时的pH |
| B.CH3COONa溶液中Na+和CH3COO-的浓度 |
| C.相同温度下,0.1 mol/LCH3COOH溶液和0.3 mol/LCH3COOH溶液的电离平衡常数 |
| D.用0.1 mol/LNaOH溶液分别中和pH、体积均相同的盐酸和醋酸,所消耗NaOH溶液的体积 |