在10℃时某化学反应速率为0.1 mol/(L•s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6 mol/(L•s),该反应需在什么温度下进行? ( )
| A.30℃ | B.40℃ | C.50℃ | D.60℃ |
已知
(l)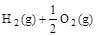 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
(2)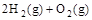 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
(3)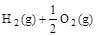 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·
(4)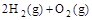 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
下列关系式中正确的是
| A.a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
下列热化学方程式中△H代表燃烧热的是
| A.CH4 ( g ) + 3/2O2 ( g ) = 2H2O ( l ) + CO ( g ) △H1 |
| B.S ( s ) + 3/2O2 ( g ) = SO3 ( s ) △H2 |
| C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l ) △H3 |
| D.2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H4 |
同温同压下,已知下列各反应为放热反应,下列各热化学方程式中热量数值最小的是
| A.2A ( l ) + B ( l ) =" 2C" (g ) △H1 |
| B.2A ( g ) + B ( g ) =" 2C" (g ) △H2 |
| C.2A ( g ) + B ( g ) =" 2C" ( l ) △H3 |
| D.2A ( l ) + B ( l ) =" 2C" ( l ) △H4 |
下列说法正确的是
| A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。 |
| B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据。 |
| C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态。 |
| D.凡是化合反应都是放热反应,分解反应都是吸热反应。 |
下列属于氧化还原反应又是吸热反应的是
| A.二氧化碳与赤热的炭反应生成一氧化碳 |
| B.葡萄糖在人体内氧化分解 |
| C.锌粒与稀H2SO4反应制取H2 |
| D.Ba(OH)2·8H2O与NH4Cl反应 |