氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。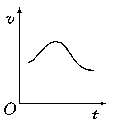
(1)反应开始进行时,反应速率加快的原因是(要求写出化学方程式)
;
(2)反应后期,反应速率下降的原因是
。
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下: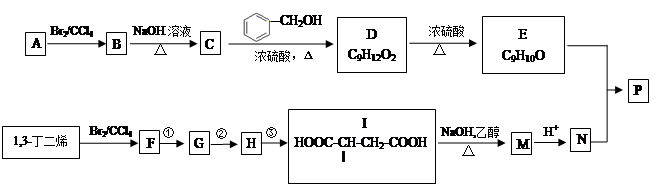
(1)A的结构简式为________________
(2)C的名称为
(3)I由F经①~③合成,F可以使溴水褪色.
a.①的化学方程式是
b.②的反应试剂是
c.③的反应类型是
(4)下列说法正确的是
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol最多消耗3molNaOH
d.N不存在顺反异构体
(5)高聚物P的亲水性,比由E形成的聚合物__________(填“强、弱”).
(6)E与N按照物质的量之比为1:1发生共聚生成P,P的结构简式为
(7)E有多重同分异构体,符合下列条件的异构体由 种(不考虑顺反异构),写出其中的一种
a.分子中只含一种环状结构
b.苯环上有两个取代基
c.1mol该有机物与溴水反应时能消耗4molBr2
用芒硝(Na2SO4 °10H2O)制备纯碱、明矾铵[(NH4)2Al(SO4)2°12H2O]的生产工艺流程如下图:
(1)溶液C中的溶质主要是_____________
(2)明矾铵的溶液呈_____性,明矾铵可用于净水,用离子方程式说明其原理______________________
(3)过程Ⅰ中的反应温度不能超过40℃,其原因是______________________________
(4)运用化学平衡原理解释Na2SO4稍过量的原因
(5)若将Al2(SO4)3加入到A中会产生大量的沉淀和气体,导致明矾铵的产量降低,请用离子方程式解释产生该现象的原因是___________________________________________
(6)溶液E中的溶质离子为__________________
(7)已知明矾铵的溶解度随着温度的升高而增大,过程Ⅱ中得到明矾铵的系列实验操作是:、、过滤、洗涤、干燥。
直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法师常用的处理方法。
(1)用化学方程式表示NO2形成酸雨的过程____________________________
(2)利用NH3和CH4等气体除去烟气中的氮氧化物。
①NH3的电子式
②热稳定性 NH3CH4(填“>”=“<”)
③已知:CH4(g)+2O2(g)=CO2(g)+2H20(l)△H1=akJ/mol; 欲计算反应CH4(g)+4NO(g)=CO2(g)+2H20(l)+2N2(g)的焓变 △H2则还需要查询某反应的焓变△H3,当反应中各物质的化学计量数之比为最简整数比时,△H3=bkJ/mol,该反应的热化学方程式是__________________________据此计算出△H2=kJ/mol (用含a、b的式子表示)。
(3)利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式______________________________________现有标况下的O233.6ml,理论上可以处理该氮氧化物______ml(标准状况下)。
某有机物A在一定条件下的转化关系如图所示,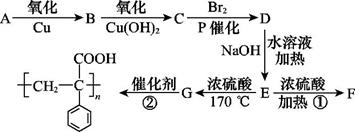
其中两分子E生成环状化合物F,D的结构简式为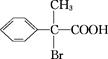
回答下列问题:
(1)写出反应类型:①,②(每空2分)。
(2)写出有机物C、F的结构简式:、(每空2分)。
(3)写出下列化学方程式:A—B:,E—G:(每空2分)。
(4)C的同分异构体有多种,其中属于苯的二取代物,且既能有银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有种,请写出其中任意一种的结构简式:。
三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式:。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是,配位数为。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| Q |
2080 |
4000 |
6100 |
9400 |
| R |
500 |
4600 |
6900 |
9500 |
| S |
740 |
1500 |
7700 |
10500 |
| T |
580 |
1800 |
2700 |
11600 |
| U |
420 |
3100 |
4400 |
5900 |
①在周期表中,最可能处于同一族的是和。
②T元素最可能是(填“s”“P” “d”或“ds”等)区元素,位于族。若T为第2周期元素,F是第3周期元素中原子半径最小的元素,则T与F形成化合物的空间构型为,其中心原子的杂化方式为。