写出下列有机物的结构简式:
(1)2,6-二甲基-4-乙基辛烷: ;
(2)2-甲基-1-戊烯: ;
(3)有A、B、C三种烃,它们的结构简式如下图所示: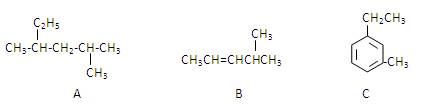
A的名称是 ;B的名称是 ;
C的名称是 。
(1)铁是人体中重要的微量元素,血红蛋白中存在价铁;医学上常用硫酸亚铁糖衣片治疗贫血,药片上糖衣的作用是。
(2)明矾可用作净水剂,写出硫酸铝钾的电离方程式;明矾能净水是因为Al3+的水解产物能吸附水中的悬浮杂质而沉降。
(3)白炽灯用金属钨作灯丝是因为。
(4)地壳中含量最多的金属是,人体中含量最多的金属是。
元素周期律是指元素的性质随的递增,而呈性变化的规律,这里元素的性质主要是指和;提出元素周期律并根据周期律编制第一个元素周期表的科学家是。
(1)写出下列反应的离子方程式:
①氯化铵溶液和氢氧化钠溶液反应;
②少量二氧化碳通入澄清石灰水;
③三氧化二铁和盐酸反应。
(2)铜和浓硫酸发生反应的化学方程式为:Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生反应;浓H2SO4作_________剂,具有性。
CuSO4+SO2↑+2H2O,其中硫元素被________(填“氧化”或“还原”,下同),发生反应;浓H2SO4作_________剂,具有性。
(1)0.5 mol CH4的质量为,其中约含有个H,在标准状况下的体积为。
(2)Na2CO3的摩尔质量是______________,5.3g Na2CO3的物质的量为____________,将其配成500mL溶液,所得溶液中Na2CO3的物质的量浓度为____________。
现有以下物质:
①NaCl晶体②液态HCl③CaCO3固体 ④熔融KCl
⑤蔗糖 ⑥铜⑦CO2⑧H2SO4⑨KOH固体
(1)以上物质中能导电的是________。
(2)以上物质中属于电解质的是_______,属于非电解质的是_______。
(3)以上物质中,溶于水且能导电的物质是________。