在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g) 3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
请回答下列问题,
(1)该反应的焓变△H 0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω= ,A物质的转化率与B物质的转化率之比为 。
(3)30℃时,若在同一容器中加入1.5 mol A、 mol B和1.5 mol C,则平衡混合气中C的体积分数仍为ω,此时平衡体系中A的物质的量浓度为 mol·L-1。
某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为。
(2)A可与溴的四氯化碳溶液反应,写出A的结构简式。
(3)已知: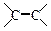

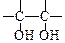 。则A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式可表示:。
。则A与稀、冷的KMnO4溶液在碱性条件下反应产物的结构简式可表示:。
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式。
下图为苯和溴取代反应的改进实验装置。其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑。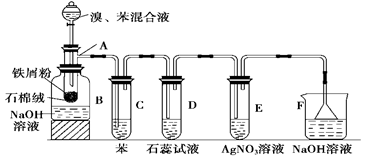
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式): ,该反应的类型为 反应。
(2)试管C中苯的作用是 ;反应开始后,观察D试管,看到的现象为 ;能说明苯与溴发生的是取代反应而不是加成反应的现象为 。
(3)在上述整套装置中,具有防倒吸作用的仪器有 (填字母)。
(4)实验结束后,得到粗溴苯要用如下操作提纯,①蒸馏;②水洗;③用干燥剂干燥;④用10% NaOH溶液洗;⑤分液。正确的操作顺序是()
| A.⑤④②①③ | B.④②⑤③① | C.④②⑤①③ | D.④⑤③①② |
用一只量筒收集CH4和Cl2的混合气倒扣在盛水的水槽中,用灯光照射量筒中的混合气体,一段时间后,可以观察到量筒内气体颜色,量筒壁上出现
,量筒内水面,量筒中的水溶液呈性。该反应的化学方程式是
(只写第一步)。
 已 知C分子结构中只含有一种氢。F为高分子化合物,结构为:
已 知C分子结构中只含有一种氢。F为高分子化合物,结构为: ,其他物质转化关系如下:
,其他物质转化关系如下:
乙苯+Cl2———→ A ———→ B —
⑤ F
C + Br2——③→ D ———→ E —
(1) C的结构简式是:,名称为:E的键线式为:
(2)框图中属于取代反应的是(填数字代号):
(3)写出②反应进行所需条件:
(4)写出反应④的化学方程式:
有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示: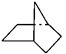
(1)写出其分子式。
(2)当降冰片烷发生一氯取代时,能生成种沸点不同的产物。
(3)根据降冰片烷的键线式结构,请你判断:降冰片烷属于。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是。
a.能溶于水b.能燃烧c.能使酸性高锰酸钾溶液褪色
d.能发生加成反应 e. 能发生取代反应 f. 常温常压下为气体