将250mLH2SO4的质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到1000mL。
(1)浓硫酸的物质的量浓度是多少?
(2)此时溶液中H2SO4的物质的量是多少?
(3)稀释后溶液中H+的物质的量浓度是多少?
是锂离子电池中广泛应用的电解质。某工厂用
、
为原料,低温反应制备
,其流程如下:
已知:
的沸点是-85.0 ℃,
的沸点是19.5 ℃。
(1)第①步反应中无水
的作用是、。反应设备不能用玻璃材质的原因是(用化学方程式表示)。无水
有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中
极易水解,其产物为两种酸,写出
水解的化学方程式:。
(3)第④步分离采用的方法是;第⑤步分离尾气中HF、HCl采用的方法是。
(4)
产品中通常混有少量
。取样品
。测得
的物质的量为
,则该样品中
的物质的量为
(用含有
、
的代数式表示)。
酯(
)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
(1)
为加成反应,则
的结构简式是;
的反应类型是。
(2)
中含有的官能团名称是;
的名称(系统命名)是。
(3)
的化学方程式是。
(4)
是
的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(
)。
的结构简式是。
(5)下列说法正确的是。
a.
能和
反应得到聚氯乙烯的单体
b.
和
中均含有2个
键
c.1
完全燃烧生成7
d. 能发生加成、取代反应
是常见的六种元素。
(1)
位于元素周期表第周期第族;
的基态原子核外有个未成对电子;
的基态原子核外电子排布式为。
(2)用">"或"<"填空:
| 第一电离能 |
离子半径 |
熔点 |
酸性 |
(3)
与
反应生成
和一种黑色固体。在25 ℃、101
下,已知该反应每消耗1
,放热44.4
,该反应的热化学方程式是。
(4)
是常用于水的净化,工业上可用
氧化
溶液制取
。写出该反应的离子方程式,并标出电子转移的方向和数目。
PMMA俗称有机玻璃,是迄今为止合成透明材料中质地最优异的一种,其合成线路如下图所示: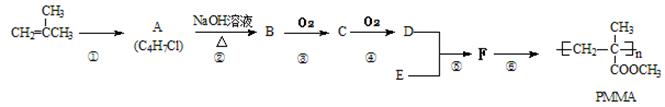
已知:在一定条件下可以发生如下反应:
(X代表卤素)
回答下列问题:
(1) F的结构简式为,所含官能团的名称是。
(2)写出A的结构简式,④的反应类型。
(3)写出③、⑤反应的化学方程式:
③,
⑤。
(4)有机物N能使溴水和酸性高锰酸钾褪色,且与有机物M互为同分异构体,请写出满足要求的所有N的结构简式。
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 |
元素性质与原子(或分子)结构 |
| T |
最外层电子数是次外层电子数的3倍 |
| X |
常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y |
M层比K层少1个电子 |
| Z |
第3周期元素的简单离子中半径最小 |
(1)写出元素T在元素周期表中的位置 。
(2)元素Y与元素Z相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
e.Y失去电子的数目比Z少
(3)T、X、Y、Z中有两种元素能形成一种淡黄色的固体,写出该化合物的电子式 ,该物质中含有的化学键是 。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时密度等于氧气,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 。
(5) X与Z形成的化合物ZX结构类似金刚石,最高可稳定到2200℃,推测属于
晶体。打开盛有ZX的袋口可闻到氨气味,故应避水保存,写出变质反应的化学方程式
。