硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
⑴根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加___________g。
⑵配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O g。
⑶现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况下)CO2时,吸收液质量就增加44g。
①吸收液中NaNO2和NaNO3的物质的量之比
② 1000g 质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2 克(0℃时,NaNO2的溶解度为71.2g/100g水)
在一定条件下的下列可逆反应达到平衡时,试填出:xA+yB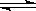 zC
zC
(1)若A、B、C都是气体,增大压强,平衡向正反应方向移动,则x+y与z关系是_______;
(2)若B、C是气体,A是固体,增大A的浓度,平衡(填“正向移动”、“逆向移动”或“不移动”);
(3)若升高温度后,C的百分含量减小,则正反应是(填“吸热”或“放热”)反应。
(4)若该可逆反应达到平衡时加入催化剂,平衡(填“正向移动”、“逆向移动”或“不移动”);
农业上常说:“下一场雷雨相当于追一次肥,”即雷雨对农作物的生长有利。请尝试用化学方程式解释原因:
;;;
对于下列反应:2SO2 + O2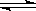 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________ mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________ mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
大理石与盐酸反应的反应速率如右图所示,已知该反应为放热反应。
(1)写出该反应的离子反应方程式:。
(2)反应开始时反应速率加快的原因是:。
(3)反应后期反应速率下降的原因是:。
氮族元素位于元素周期表的族,其中非金属性最强的元素是。随着核电荷数的递增,氮族元素的原子半径逐渐,其气态氢化物的稳定性逐渐。