实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题
(1)请写出该实验的实验步骤
① ,② ,③ ,④ ,⑤ 。
(2)所需仪器为:容量瓶 (规格: )、托盘天平、还需要那些实验仪器才能完成该实验,请写出: 。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
①为加速固体溶解,可稍微加热并不断搅拌。在未降至室温时,立即将溶液转移至容量瓶定容。对所配溶液浓度的影响: (填“偏高”“偏低”或“不变”),原因是: 。
②定容后,加盖倒转摇匀后,发现溶面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响 ,原因是: 。
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① |
||||||||
| ② |
③ |
④ |
||||||
| ⑤ |
⑥ |
⑦ |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答: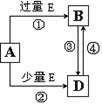
①E的电子式为。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为g。
(1)如图所示,将氯气依次通过盛有干燥有色布条的和盛有潮湿有色布条的广口瓶,可观察到的现象是。
(2)为防止氯气尾气污染空气,通常用溶液吸收多余的氯气;石灰乳吸收工业氯气尾气可制得漂白粉,漂白粉溶于水漂白织物时发生反应的离子方程式为。
(3)氯气一旦泄漏,后果是非常严重的。当人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是。
| A.NaOH | B.NaCl | C.KBr | D.Na2CO3 |
a、b、c、d、e是含有一种相同元素的五种物质,可发生如图所示的转化。其中: a是单质;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是淡黄色固体、b是臭鸡蛋气味的气体。则a的化学式为,b、e的名称分别为、c变d的化学方程式为。
(2)如果a是空气中含量最大的气体、b为气态氢化物,d是红棕色气体。则c的化学式为;a生成b的化学方程式为;d生成e的离子方程式为。
现有四种短周期元素X、Y、Z、W,它们的原子序数依次增大。其中:①X原子是元素周期表中原子半径最小的;②Y的L层电子是K层电子的2倍;③Z的最外层电子是内层电子的3倍;④W与X同主族。请回答下列问题:
(1)X的元素符号为,Y在周期表中的位置是 ,
Z单质的化学式为。
(2)X与Z组成的含有非极性共价键的化合物的分子式为 ;化合物W2Z2的电子式为 。
(3)向Na2SiO3的溶液中缓慢通入过量的YZ2,反应的离子方程式是 ;分子中有10个电子,则X与Z组成的分子为、X与Y组成的分子式为_______。
(1)写出下列反应的化学方程式:
①铝热反应(铝粉与四氧化三铁):;
②铜片与过量的浓硫酸共热:;
(2)写出下列反应的离子方程式:
③铵盐溶液与烧碱溶液共热:;
④铜片与浓硝酸反应:。