在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下将0.01 mol NH4Cl和0.002 mol NaOH溶于水配成1L溶液。
①溶液中浓度为0.01 mol·L-1的离子是 。
②物质的量之和为0.01 mol的两种粒子是 和 。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 (填“碱性”、“酸性”或“中性”),醋酸体积 氢氧化钠溶液体积(填“>”、“<”或“=”)。
(3)将m mol·L-1的醋酸和n mol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7, m与n的大小关系是m n。(填“>”、“<”或“=”)
(4)浓度为0.100 mol·L-1的下列各物质的溶液中,c( )由大到小的顺序是
)由大到小的顺序是
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(5)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA- HA- H++A2-
H++A2-
已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度
0.11 mol·L-1(填“>”“=”或“<”)。
实验室欲用NaNO3固体配制80 mL 1.4 mol·L-1的NaNO3溶液,试回答:
(1)用不到的仪器是__________;
A.烧杯B.500 mL容量瓶 C.量筒
D.胶头滴管 E.玻璃棒 F.100 mL容量瓶
(2)配制时应称取NaNO3__________g;
(3)实验开始时,需检查容量瓶__________;
(4)在配制一定物质的量浓度溶液的实验中,下列操作对所配溶液浓度无影响的是(写字母) __________;会使所配溶液浓度偏大的是__________;会使所配溶液浓度偏小的是__________。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.未将洗涤烧杯内壁的溶液转移入容量瓶
C.容量瓶中所配的溶液液面未到刻度线便停止加水
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
F.容量瓶中液面将达到刻度线时,俯视刻度线和液面
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题: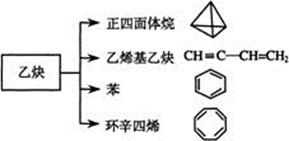
(1)正四面体烷的分子式为,其三氯取代产物有种
(2)关于乙烯基乙炔分子的说法正确的是:
a. 不能使酸性KMnO4溶液褪色
b. 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
c. 乙烯基乙炔分子中的四个C原子可能在一条直线上
d. 1摩尔乙烯基乙炔能与3摩尔Br2发生取代反应
(3)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举一例):。
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式
某含C、H、O三种元素的未知A,经燃烧分析实验测定该未知物中碳的质量分数为52.16%,氢的质量分数为13.14%。
(1)该未知物A的实验式为。能否直接依据A的实验式确定A的分子式。(填“能”或“否”)
(2)A物质在浓硫酸和170℃的条件下生成一种化工原料B,写出B物质在催化剂的条件下生成高分子化合物的化学方程式。
(一)某烯烃与H2发生加成反应后得到的产物是CH3—CH(CH3)2.
⑴原来烯烃的名称是
⑵ 原来烯烃的结构简式为:
⑶ 写出原来的烯烃使溴的四氯化碳溶液褪色的化学反应方程式:
(二)某烷烃碳架结构如图所示: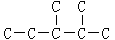 ,
,
(1)此烷烃的一溴代物有种
(2)若此烷烃为炔烃加氢制得,则此炔烃的结构简式为
(3)若此烷烃为单烯烃加氢制得,则此烯烃的结构有种
(1)有机物CH3CH(C2H5)CH(C2H5)CH(CH3)2按系统命名法命名的名称是
(2) 卤代烃C5H11Cl中含有2个-CH3的同分异构体有种
(3) 已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则混合气体中碳元素的质量分数为