能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 。
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具 有非常光明的前途。富勒烯(C60)的结构如图,分子中碳原子轨道的杂化类型为 ;1mol C60分子中σ键的数目为 。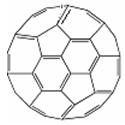
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如图所示),硫离子的配位数是 。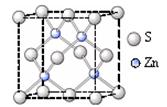
③二氧化硒分子的空间构型为 。
(4)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图,请在下图中用箭头表示出配位键。
A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。回答以下问题: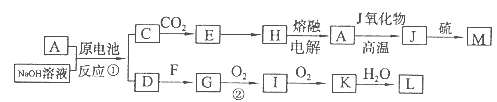
(1)A的原子结构示意图为,M的化学式为。
(2)A与NaOH溶液反应的离子方程式为。
(3)写出②的化学方程式。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。X的水溶液与NaHCO3溶液混合,反应的离子方程式为。
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下: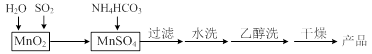
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、。
⑵①检验水洗是否合格的方法是。
②水洗结束后,用乙醇洗涤的目的是。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为;图中点D对应固体的成分为(填化学式)。
下图所示的是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。已知X、Y、Z是日常生活中常见金属单质,X由地壳中含量最高的金属元素组成;D、E是常见气态非金属单质,其中D呈黄绿色。A的焰色反应呈紫色(透过蓝色钴玻璃),F的稀溶液呈蓝色。
请回答下列问题:
⑴ C的电子式为。
⑵ I露置于空气中,颜色由白色迅速变成灰绿色,最终变成红褐色,该反应的化学方程式为。
⑶ X与C溶液反应的离子方程式为。
⑷ 写出J与Y反应的化学方程式,并标出电子转移的方向和数目:。
⑴探究物质的结构有助于对物质的性质进行研究。
① 下列物质中含有醇羟基的是(填字母)。
a.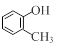 b.
b. c.
c.
② 下列物质分子中所有原子处于同一平面的是(填字母)。
a.溴苯 b.丙烯 c.甲醇
③ 欲区分HCHO和HCOOH,应选用(填字母)。
a.NaOH溶液 b.酸性KMnO4溶液 c.NaHCO3溶液
⑵有机化学中的同分异构现象十分普遍。
① C3H6O的一种有机物能与新制的氢氧化铜悬浊液反应,该有机物的结构简式为。
② 有机物C5H10O2属于羧酸类的同分异构体有种,其中一种的核磁共振氢谱图(1H核磁共振谱图)中显示两个峰,该有机物的结构简式为。
③环状化合物M(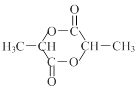 )由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为。
)由两分子某链状有机物A反应得到,则与链状有机物A互为同分异构体且含有相同官能团的结构简式为。
⑶科学家常采用将药物连接在高分子载体上,制成缓释长效药物。已知某种解热镇痛类药物的结构简式为A,把它连接到高分子聚合物B上,形成缓释长效药物C。
A: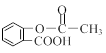 C :
C :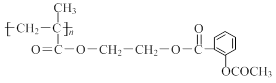
① HO-CH2-CH2-OH的名称为。
② 高分子聚合物B的单体的结构简式为。
③ A与B反应生成C的反应类型是。
④ 在酸性条件下,A可水解成CH3COOH和(填结构简式)。
请写出检验A是否已水解的实验方法和现象。
化合物H是重要的有机化合物,可由E和F在一定条件下合成:(有些反应条件省略如:加热等)
已知以下信息:
A属于芳香烃,H属于酯类化合物。
I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)B的结构简式,C的官能团名称。
(2)B C;G
C;G J两步的反应类型 ,。
J两步的反应类型 ,。
(3)①E+F H的化学方程式。
H的化学方程式。
②I G 的化学方程式。
G 的化学方程式。
(4)H的同系物K比H相对分子质量小28,K的同分异构体中能同时满足如下条件:
①属于芳香族化合物
②能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。
K的一个同分异构体能发生银镜反应,也能使FeCl3溶液显紫色,苯环上有两个支链,苯环上的氢的核磁共振氢谱为二组峰,且峰面积比为1:1,写出K的这种同分异构体的结构简式。