热化学方程式:2H2(g)+O2(g)=2H2O(I) △H= -571.6kJ/mol表示的意义是
H2(g)+1/2O2(g)=H2O(l) △H=
①配平:□KMnO4+□HCl→□KCl+□MnCl2+□Cl2+□□;
②0.2mol/LNaHSO4溶液中H+浓度为0.2mol/L,该溶液与0.1mol/LBa(OH)2溶液等体积反应时的离子方程式为 。
一定温度压强下,a L氧气含有b个原子,此时c L氧气的质量是 g
现有K2SO4和H2SO4的混合溶液100mL。其中K2SO4物质的量浓度为1mol/L,H2SO4的物质的量浓度为0.5mol/L。现要求将上述混合溶液中K2SO4的浓度变为0.2mol/L,H2SO4的浓度变为2mol/L,应加入98%(密度1.84g/mL)的硫酸 毫升(保留两位小数),然后再加水稀释到 毫升?
已知: MnO2 +4HCl(浓)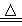 MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100ml过量的浓盐酸中,当反应生成3.36L Cl2气体时(标况),剩余溶液中盐酸的浓度为4mol/L(假设反应前后体积不变)。请回答下列问题:
MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100ml过量的浓盐酸中,当反应生成3.36L Cl2气体时(标况),剩余溶液中盐酸的浓度为4mol/L(假设反应前后体积不变)。请回答下列问题:
(1)该反应的氧化剂为 ;氧化产物为 (化学式填写)。
(2)反应耗用MnO2的质量为 ;
(3)被氧化的HCl物质的量为 ;
(4)原浓盐酸的物质的量浓度为 。
对某些化学反应,由于反应物用量不同,产物也会有所不同,试根据溶液中离子反应的初步知识,完成下列情况下的离子方程式。
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子反应方程式 ;
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,写出发生反应的离子方程式 ;
(3)向Ba(OH)2溶液中逐滴加入NaHSO4至恰好完全沉淀,写出反应的离子方程式 ;
(4)在(3)的溶液中,继续滴加NaHSO4溶液,写出发生反应的离子方程式 。