洗涤下列仪器的方法不正确的是(指在用水冲洗之前) ( )
| A.做过银镜反应的试管用盐酸洗涤 |
| B.久置石灰水的试剂瓶用盐酸洗涤 |
| C.实验室用高锰酸钾制取氧气后的试管壁沾有的固体用热浓盐酸洗涤 |
| D.盛过油脂的试管用碱液洗涤 |
下列化学用语或模型正确的是
A.氯化氢的电子式: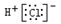 |
B.N2的结构式:N≡N |
C.硫离子结构示意图: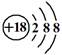 |
D.CH4分子的球棍模型: |
自然界中存在的碘的稳定性核素是碘-127(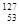 I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131(
I)。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘-131( I)。碘-131 (
I)。碘-131 ( I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
I) 一旦被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是
A. I是一种新元素 I是一种新元素 |
B. I的摩尔质量为131g I的摩尔质量为131g |
C. I和 I和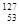 I互为同位素 I互为同位素 |
D.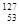 I中子数与质子数之差为74 I中子数与质子数之差为74 |
已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A顺序依次减小,B和E同主族,下列推断不正确的是
A.A、B、E一定在不同周期
B.C的最高价氧化物的水化物可能显碱性
C.C和D的单质可能化合形成离子化合物
D.A、D可能在同一主族
分别处于第二、三周期的主族元素A和B,它们的离子的电子层相差2层。已知A处于第m族;B处于第n族;A只有正化合价。则A、B原子核外电子总数分别为
A、m、n B、3、7 C、m-2、10n D、m+2、n+10
已知Cu(NO3)2受热分解的化学反应方程式为:2Cu(NO3)2 2CuO+4NO2↑+O2↑,某人将少量的Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是:
2CuO+4NO2↑+O2↑,某人将少量的Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是:
| A.NO2能支持燃烧 |
| B.NO2不能支持燃烧 |
| C.木条复燃是因为硝酸铜分解产生了氧气的缘故 |
| D.木条复燃是因为硝酸铜分解产生的CuO催化作用的结果 |