能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) 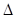 H=-570kJ/mol ;② H2(g)+1/2O2(g)=H2O(g)
H=-570kJ/mol ;② H2(g)+1/2O2(g)=H2O(g) 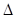 H="-242kJ/mol"
H="-242kJ/mol"
③ C(s)+1/2O2(g)="CO" (g) 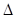 H=" —110.5kJ/moL" ④ C(s)+O2(g)=CO2(g)
H=" —110.5kJ/moL" ④ C(s)+O2(g)=CO2(g) 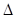 H="-393.5kJ/moL"
H="-393.5kJ/moL"
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g) 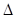 H=" +890kJ/moL"
H=" +890kJ/moL"
回答下列问题:
(1)上述反应中属于吸热反应的有(填写序号) 。
(2)H2的燃烧热为 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。 已知C(s) + H2O(g) = H2(g)+ CO (g) 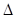 H=akJ/moL;
H=akJ/moL;
则a= ; 又已知自由能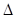 G=
G=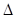 H—T
H—T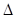 S,当
S,当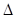 G<0时可自发进行。则该反应在什么条件下可自发进行 。
G<0时可自发进行。则该反应在什么条件下可自发进行 。
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”).
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
Co(OH)3溶解还原反应的离子方程式为 ,铁渣中铁元素的化合价为 ,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为 。
用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II: 2NO(g)+O2(g)  2NO2(g) △H2(且|△H1| =2|△H2|)
2NO2(g) △H2(且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
| 温度/K |
反应I |
反应II |
已知: |
| 298 |
K1 |
K2 |
|
| 398 |
K1′ |
K2′ |
(1)△H3 = (用△H1、△H2 的代数式表示);推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法不正确的是 。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO)∶n(O2)∶n(NO2)=2∶1∶2。恒温恒压时,在其它条件不变时,再充入NO2气体, NO2体积分数 (填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,溶液中OH-向电极 移动(填a或b),负极的电极反应式为 。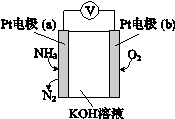
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3 + CO2 + NaCl + H2O ="=" NH4Cl + NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置中所发生反应的离子方程式为: 。
C装置中稀硫酸的作用为: 。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
|
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
参照表中数据,请分析B装置中使用冰水是因为 。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。
从樟科植物枝叶提取的精油中含有下列甲、乙两种成分:
(1)乙中所含官能团的名称为 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
设计步骤①的目的是 ;指出①的反应类型 。
③反应的化学方程式为 (注明反应条件)。
(3)欲检验乙中的含氧官能团,选用下列的一种试剂是__________。
| A.溴水 | B.酸性高锰酸钾溶液 | C.溴的CCl4溶液 | D.银氨溶液 |
(4)乙经过氢化、氧化得到丙( 。丙的同分异构体中,既有苯环,又有羧基的共有 种。任意写出一种同时符合下列要求的丙的同分异构体结构简式_____________。
。丙的同分异构体中,既有苯环,又有羧基的共有 种。任意写出一种同时符合下列要求的丙的同分异构体结构简式_____________。
①能发生银镜反应;
②能与FeCl3溶液发生显色反应;
③核磁共振氢谱图上产生4个吸收峰。
某化学兴趣小组利用废弃铝矿(含CuO、Al2O3及SiO2),模拟工业上提取铝的工艺,设计如下图所示的简单操作流程:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)滤渣主要成分的化学式为_________。
(2)灼烧Al(OH)3时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有_______(填仪器名称)。
(3)溶液Y中要加入稍过量原料A,原料A的化学式是_______。
(4)操作流程中③的离子方程式为_____________。
(5)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示:
请写出该电池正极反应式 。