证明淀粉在酶作用下只部分发生了水解的实验试剂是 ( )
| A.碘水 | B.氢氧化钠溶液、银氨溶液 |
| C.烧碱溶液、新制Cu(OH)2溶液 | D.碘水、烧碱溶液、Cu(OH)2悬浊液 |
下列变化需要加入还原剂才能实现的
A.MnO4-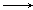 Mn2+ Mn2+ |
B.HCl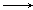 Cl2 Cl2 |
C.Fe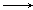 Fe3+ Fe3+ |
D.KClO3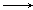 O2 O2 |
能正确表示下列化学反应的离子方程式的是
| A.氢氧化铜溶液与盐酸的反应 OH-+H+= H2O |
| B.澄清的石灰水与稀盐酸反应 Ca(OH)2 + 2H+= Ca2+ + 2H2O |
| C.铜片插入硝酸银溶液中 Cu + Ag+= Cu2+ + Ag |
| D.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2 |
0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比
| A.5:2 | B.3:1 | C.15:2 | D.1:3 |
欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
用NA表示阿伏德罗常数,下列叙述正确的是
| A.标准状况下,22.4LH2O含有的分子数为1 NA |
| B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C.通常状况下,1 NA个CO2分子占有的体积为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |