铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-= Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2 Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
将铁、铝、硅的混合物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份跟足量稀硫酸反应,最终产生的H2一样多,则铁与硅的物质的量之比为
| A.2:1 | B.4:1 | C.1:1 | D.3:1 |
能说明Al的金属活动性比Cu强的事实是
| A.以铝为阳极、铜为阴极电解硫酸铜溶液时,阳极铝溶解 |
| B.与氯气反应时,铝失去3个电子,而铜失去2个电子 |
| C.常温下,铝在浓硝酸中钝化而铜不发生钝化 |
| D.常温下将铝和铜用导线连接放入到稀盐酸中,铝为负极 |
下列陈述正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
SO2有漂白性 |
SO2可使溴水褪色 |
| B |
SiO2有导电性 |
SiO2可用于制备光导纤维 |
| C |
浓硫酸有强氧化性 |
浓硫酸可用于干燥H2和CO |
| D |
Fe3+有强氧化性 |
FeCl3溶液可用于回收废旧电路板中的铜 |
下列各图所示实验设计能达到相应实验目的的是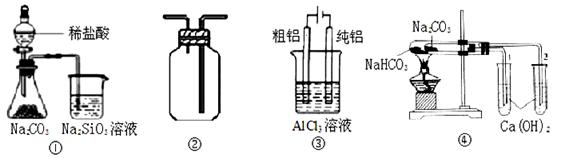
| A.用图①装置验证氯、碳、硅元素非金属性 |
| B.用图②装置能收集O2、CO2和H2 |
| C.用图③装置电解精炼铝 |
| D.用图④装置验证NaHCO3和Na2CO3的热稳定性 |
将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。以下推测肯定不正确的是
| A.①中红色褪去的原因是KMnO4将SCN-氧化 |
| B.②中红色褪去的原因是SO2将Fe3+还原成Fe2+ |
| C.②中红色褪去的原因是SO2将SCN-还原 |
| D.SCN-在适当条件下可失去电子被氧化为(SCN)2 |