23实验室有一瓶碳酸钠试剂,含有少量的硫酸钠杂质,某学生设计以下实验来确定其纯度。
| A.称取样品W1 g | B.加盐酸酸化 | C.用蒸馏水溶解 | D.过滤 |
E.加入过量的氯化钡溶液 F.洗涤沉淀 G.干燥沉淀 H.称量沉淀的质量W2 g
(2)酸化时盐酸必须过量,其目的是______ 。
(3)氯化钡溶液要过量的目的是______ 。检验氯化钡过量的方法是______ 。
(4)检验沉淀已洗涤干净的方法是______ 。
(5)样品中碳酸钠的纯度为______ 。
现有以下物质:①KCI晶体②食盐水③液态的醋酸④I2⑤BaSO4固体⑥蔗糖(C12H22O11 )⑦酒精(C2H5OH)⑧熔融的NaOH⑨K2O⑩SO2。请回答下列问题:
(1)以上物质中能导电的是_________________(用序号)。
(2)以上物质属于电解质的是_________________(用序号)。
(3)以上物质中属于非电解质的是_________________(用序号)。
(4)从②溶液中得到氯化钠固体,应选择下列装置中的______________(填代表装置图的字母,下同);分离④与⑦的混合液,应选择下列装置中的________________。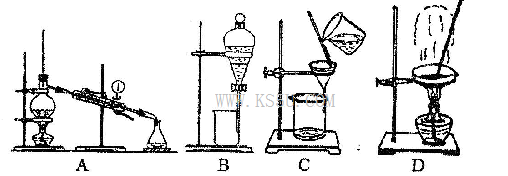
(5)请写出③和⑧中两种物质的溶液混合后发生反应的离子方程式:________________________________________________________________________.
(6)在标准状况下,__________L⑩与34. 2g⑥中含有相同的氧原子数。
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H=-110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H=-157kJ·mol-1
用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式是:
(2)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为:。
(4)铁在潮湿的空气中发生吸氧腐蚀的电池反应方程式为。
(5)“镁—次氯酸盐”燃料电池,其装置示意图如图,该电池反应的总反应方程式为_______________。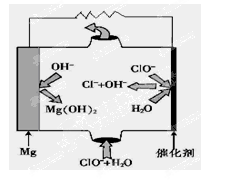
(6)工业上电解熔融氯化钠的方程式为。
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。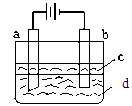
(1)b电极材料为______,其电极反应式为_____________________。
(2)(选择填空)电解时,当在电极上有白色沉淀生成时,电解液d是_____;当在两极之间的溶液中有白色沉淀生成时,电解液d是______。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(3)液体c为苯,其作用是________________,在加入苯之前,对d溶液进行加热处理的目的是_______________________。
(4)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为_________________________________。该现象的化学反应方程式为
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
| 编号 |
物质(微粒) |
电离度α |
| A |
硫酸溶液(第一步完全电离):第二步 HSO4- H++SO42- H++SO42- |
10% |
| B |
硫酸氢钠溶液: HSO4- H++SO42 H++SO42 |
29% |
| C |
醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ |
1.33% |
| D |
盐酸: HCl=H++Cl- |
100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是(填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是。
(3)醋酸的电离平衡常数K的表达式是,醋酸的电离平衡常数
K与电离度α的关系式为:K=(用含α的代数式表示)
将2.3克钠投入到水(滴有酚酞)中,反应结束后,溶液是0.1升。则:
(1)反应过程中,可以发现钠浮在水面,说明钠的密度(填“大于”“小于”“等
于”)水的密度,溶液最后显色。
(2)化学反应方程式是。
(3)求最后溶液的物质的量浓度是多少?(写出解题过程)