实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:
NaNO2+NH4Cl===NaCl+NH4NO2
NH4NO2 N2↑+2H2O。
N2↑+2H2O。
制取装置如图所示: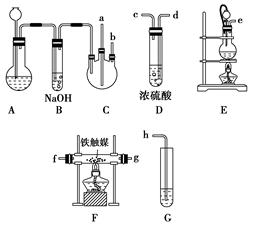
(1)装置A用于制取________。
(2)装置E中分液漏斗上方常用导管与圆底烧瓶相通,作用是________。装置E与装置C直接相连,连接时导管口连接方法为e接________。
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:另一接口________接________,________接________,________接________。
(4)装置D的作用为________。装置F导出的气体的成分为________。
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下________(填“能”或“不能”),理由是___________________________________________。
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应与________相连为佳。
某元素的原子 ,它的氯化物(MCl)1.17g溶于水形成的溶液,加入1mol/LAgNO3溶20ml恰好完全反应,若这种原子核内有12个中子
,它的氯化物(MCl)1.17g溶于水形成的溶液,加入1mol/LAgNO3溶20ml恰好完全反应,若这种原子核内有12个中子
则①Z和A的值是:,。
②请写出M元素最高价氧化物对应的水化物和与Cl元素最高价氧化物对应水化物的反应的化学方程式。
③把M的单质放入某液体中,该液体由分子构成(每个分子有三个原子核,共有十个电子)请写出有关的反应的离子方程式。
氨是一种重要的化工产品,对工业具有重要的意义。
(1)实验室收集氨气应使用法,要得到干燥的氨气可选用做干燥剂。
(2)氨气的电子式和结构式分别为:,。
已知某元素的最高价氧化物可制做光导纤维,该元素原子结构示意图为:
,所在元素周期表中的位置是。
某同学要在一个铁手镯上通过原电池原理覆盖一层银。
①写出该电池的负极反应式:,发生反应,
②正极反应式为:,发生反应。
某有机物A(只含C、H、O)是一种重要化工生产的中间体,其蒸气密度是相同状况下氢气密度的83倍。试根据下列信息回答相关问题:
①A分子中碳原子总数是氧原子总数的3倍,其苯环上只有一个取代基,且取代基碳链上无支链;
②A可与NaHCO3溶液作用,产生无色气泡;
③A在一定条件下可与乙酸发生酯化反应。
请写出:
(1)A的分子式;A的一种可能的结构简式;
A中含氧官能团的名称。
若有机物A存在如下转化关系(见下框图),请据此时A的结构回答(2)、(3)、(4)问: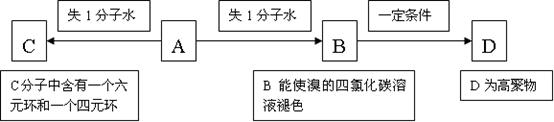
(2)请写出: A→C和B→D的化学反应方程式(注明反应条件),并注明反应类型:
A→C:,反应类型:;
B→D:,反应类型:。
(3)A的一种同分异构体F,其苯环上有两个相邻的取代基,且能与三氯化铁溶液发生显色反应。F在稀硫酸存在下水解生成G和H,其中H俗称“木精”,是饮用假酒过程中致人失明、甚至死亡的元凶。
请写出F的结构简式:。
(4)已知H在一定条件下可被氧化成K,K的水溶液常用作防腐剂,请写出:
H→K的化学方程式:。