在一定条件下,某密闭容器发生如下反应:2SO2(g)+O2(g) 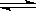 2SO3(g) , △H= -98.3kJ/mol,反应达到平衡后SO2、O2、SO3的物质的量之比为3:2:5,保持其它条件不变,升温后重新达到平衡,SO3、O2的物质的量分别为2α mol和α mol,则此时容器内SO2的物质的量应为( )。
2SO3(g) , △H= -98.3kJ/mol,反应达到平衡后SO2、O2、SO3的物质的量之比为3:2:5,保持其它条件不变,升温后重新达到平衡,SO3、O2的物质的量分别为2α mol和α mol,则此时容器内SO2的物质的量应为( )。
A.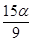 mol mol |
B.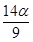 mol mol |
C.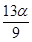 mol mol |
D.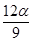 mol mol |
在某稀溶液中含有0.1mol HNO3和x mol H2SO4,向其中加入9.6 g铜粉,充分反应后产生的气体在标准状况下的体积为2.24L,则x值至少为()
| A.0.1 | B.0.12 | C.0.15 | D.0.2 |
下列不能通过化合反应制得物质的是( )
| A.FeS | B.Al(OH)3 | C.Fe(NO3 )2 | D.Fe(OH)3 |
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A.标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA |
| B.0.1 mol·L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA |
| C.足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA |
| D.常温常压下,1.6g甲烷中含有的碳原子数为0.1NA |
向一个小烧杯中加入20克蔗糖,加3~4滴水,再加入20ml浓硫酸,观察到的实验现象是:烧杯发热、蔗糖变黑、体积膨胀,变成疏松多孔的海棉状的炭,并放出有制激性气味的气体。这个过程中浓硫酸没有表现出的性质是( )
| A.吸水性 | B.脱水性 | C.强氧化性 | D.酸性 |
下列离子方程式正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C.氯化铝溶液加入氨水:Al3++3OH-=Al(OH)3↓ |
D.用氢氧化钠检验氯化铵溶液中铵根离子:NH4++OH― NH3↑+H2O NH3↑+H2O |