根据下图所示装置回答问题:
(1)用A装置制取氧气,反应的化学方程式为 。
(2)实验室若用B装置来制取二氧化碳时,往长颈漏斗中应加入 。若用G来收集二氧化碳,二氧化碳应从 进(选“a”或“b”)。
(3)制取二氧化碳最好选择的发生装置是 (选择“B”或“C”),与另一个装置相比,其优点是: 。
(4)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体。实验室制取H2S气体时,发生装置应选用 ,收集装置应选用__________ (填仪器编号)。
(5)红旗水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。)
有关实验数据如下表:
| |
反应前 |
反应后 |
|
| 实验数据 |
烧杯和稀盐酸的质量 |
石灰石样品的质量 |
烧杯和其中混合物的质量 |
| 160 g |
12 g |
167.6 g |
求该石灰石中碳酸钙的质量分数。
下面四个实验都是教材中的化学实验,请回忆并解决有关问题 (1)实验A证明蜡烛燃烧产生的火焰,外焰温度最(填“高”或“低”) 。
(1)实验A证明蜡烛燃烧产生的火焰,外焰温度最(填“高”或“低”) 。
(2)实验B是硫在氧气中燃烧实验,瓶中预先加水的目的是: 。小郑同学对该实验进行药品改进,把水替换为滴有酚酞试液的溶液,实验时既能更好达到目的,又提高实验现象的趣味性。
(3)实验C是探究酸的化学性质实验,用点滴板代替试管完成实验的好处是。
(4)实验D是蒸馏水的制取,蒸馏过程水的流向是 (填“下入上出”或“上入下出”);高温水蒸气的冷却,从微观角度看是水分子的减小了。
(5)二氧化氮是一种密度大于空气易溶于水的有毒红棕色气体,用铜片与浓硝酸(HNO3)共微热就可以制得,同时生成硝酸铜和水。现请你回顾实验室制取气体的一般思路和方法,解决下列问题:
①、补全实验室制取NO2的化学方程式:
Cu + 4HNO3(浓)△ Cu(NO3)2 +2 NO2↑+ □
②、反应原理决定实验装置的设计。根据①的方程式,要制取一瓶NO2,至少要选择上面实验装置A、B、C、D中的铁架台、、烧瓶等仪器用于组装实验装 置,收集方法可采用,并进行必要的尾气处理。整套实验装置设计组装完毕后必须检查。
③、请你预测制取NO2时的实验现象:(至少答两点)
Ⅰ:;Ⅱ:。
④、反应后所得溶液通过(填操作名称)可以获得硝酸铜晶体。
在化学实验技能考试中,有一题目是鉴别氢氧化钙溶液和氢氧化钠溶液,某同学进行了如下图所示的实验。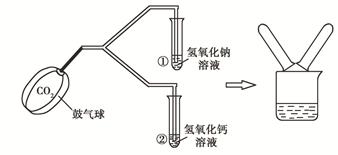
⑴写出试管②中反应的化学方程式:。
⑵当看到不同现象时停止通气体,将两支试管中的废液倒入同一个干净的烧杯中,并将废液进行过滤,同学们对滤液成分进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【查阅资料】①氯化钙溶液呈中性;
②Na2CO3+CaCl2=CaCO3↓+2NaCl
【猜想假设】 甲同学认为:只含有氢氧化钠
乙同学认为:只含有碳酸钠;
丙同学认为:含有氢氧化钠和氢氧化钙;
丁同学认为:含有氢氧化钠、碳酸钠和氢氧化钙;
你认为还可能是(写一种猜想)。
【分析讨论】你认为哪位同学的猜想不合理并说明理由。
【实验设计】设计一个简单的实验证明你的猜想正确。
| 实验步骤 |
实验现象 |
实验结论 |
| 取滤液于试管中, |
猜想正确 |
【实验分析】甲同学针对自己的猜想进行了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中,滴入少量稀盐酸 |
无明显现象 |
猜想成立 |
你认为甲同学对实验结果判断是否正确?请说明理由。
【反思拓展】
下列实验方法可以区分氢氧化钠和氢氧化钙两种固体的是(填字母)。
A.放置在空气中 B.观察颜色 C.加水溶解 D.利用溶解性
某实验小组设计了右图所示的实验装置。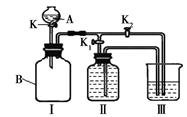
(1)甲同学认为打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是。
(2)乙同学认为利用Ⅰ、Ⅲ装置可以测定空气中氧气的含量。关闭K、K1、K2,用凸透镜引燃B中的白磷,待冷却后打开K2,整个实验过程中的现象是。
(3)丙同学认为可以利用Ⅰ、Ⅲ装置验证二氧化碳的性质。
①若要验证二氧化碳能与水发生反应,应向烧杯的水中加入;
②若广口瓶B中盛放二氧化碳,A中盛放氢氧化钠溶液,烧杯中盛放稀盐酸,验证二氧化碳能与氢氧化钠发生反应的操作是。
请根据下列装置图回答问题: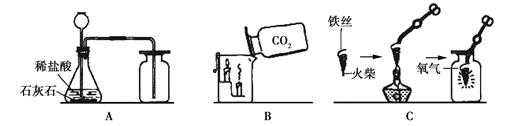
(1)A中制取气体的化学方程式为____________________________; A装置还可用于实验室制取另一种气体的化学方程式为。
(2)B中,将二氧化碳气体慢慢倒入放有燃着蜡烛的烧杯中,下层蜡烛先熄灭,说明二氧化碳具有_____________性质,这一性质在实际生活中的应用为_______。
(3)小明按C图实验时,集气瓶底部炸裂,其可能的原因是_______。
(4)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。他将镁和不同含碳量的铁 (镁和铁直径均为0. 4mm)放入氧气中燃烧,并将现象记录在下表中。
| 物质 |
镁 |
含碳0.05%的铁 |
含碳0.2%的铁 |
含碳0.6%的铁 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
(未填) |
①你认为表中未填的实验现象是。
②造成铁丝在氧气中燃烧时火星四射的主要原因是。
某化学活动小组探究金属的反应规律。
【探究一】在室温条件下进行右图所示实验。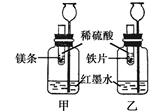
已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为。
(1)若比较镁和铁的金属活动性,观察到的现象是 ;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量(填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
【探究二】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是。
| A.滤出的固体中一定含有铜 |
| B.滤出的固体可能含有铁和镁 |
| C.滤液中可能含有硫酸铜 |
| D.滤液中一定含有硫酸镁和硫酸亚铁 |