近年,我国电子工业迅速发展,造成了大量的电路板刻蚀废液的产生和排放。刻蚀液主要有酸性的(HClH2O2)、碱性的(NH3NH4Cl)以及传统的(HClFeCl3)等三种,刻蚀废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种刻蚀废液的常见处理方法如图: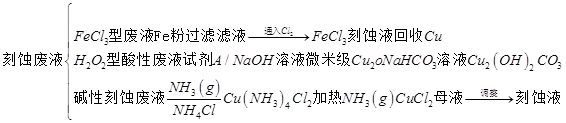
(1)FeCl3型酸性废液回收铜并使刻蚀液再生,发生的主要离子反应有Fe+Cu2+===Fe2++Cu,2Fe3++Fe===3Fe2+,还有___________________________________________________,
___________________________________________________________(离子方程式表示)。
(2)HClH2O2型刻蚀液刻蚀Cu的过程中发生的化学反应用离子方程式可表示为:________________________________________________________________________。
(3)H2O2型酸性刻蚀废液回收Cu2O过程中,所加试剂A的最佳选择是________(填序号)。
①酸性高锰酸钾溶液;②固体NaCl;③甲醛;④葡萄糖
(4)碱性刻蚀液发生的反应是:2Cu+O2+4NH4Cl+4NH3·H2O===2Cu(NH3)4Cl2+6H2O,处理碱性刻蚀废液过程中加入NH4Cl固体并通入NH3(g)的目的是:
________________________________________________________________________。
A、B、C、D、E是中学阶段常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的转化关系如图所示:
(1)X的单质与A反应的化学方程式是_______________________________。
(2)若试剂1是NaOH溶液,则X的单质与试剂1反应的离子方程式是
___________________________________
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是___________________________________。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
________________________________________________。
③某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是_____________________。
单质A与粉末化合物B组成的混合物能发生如图所示的一系列反应:
请回答下列问题:
(1)组成A单质的元素在周期表中处于第__________周期__________族。
(2)化合物B的电子式为________________________。
(3)D与G两溶液混合后发生反应的离子方程式为______________________________
(4)常温下,D溶液的pH________7(填“>”、“<”或“=”),其原因是____________________________(用离子方程式表示)。
(5)10.8 g A单质与足量的NaOH溶液反应,消耗氧化剂的质量为________ g。
(6)用碳棒、稀硫酸、气体E和气体F组成燃料电池,该电池的正极反应式为______________________。以该电池为电源,用惰性电极电解100 g 8%的C溶液,电解到溶质的质量分数为12.5%时停止电解,则电解过程中,生成的气体在准状况下的体积共为________ L,电路上通过电子的物质的量为________ mol。
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
(1)①铜帽溶解时加入H2O2的目的是________________________________________
(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是_______________________________________________________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中发生反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2
2S2O32—+I2=2I-+S4O62—
①滴定选用的指示剂为__________,滴定终点观察到的现象为__________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH |
沉淀完全的pH |
|
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Zn2+ |
5.9 |
8.9 |
、实验中可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为
①______________________________________;
②________________________________________;
③过滤;
④_________________________________________;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。
水是生命的源泉、工业的血液、城市的命脉。要保护好河流,河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康。
请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下1 mol·L-1的NaOH溶液中,由水电离出的
c(OH-)=________ mol·L-1。
(2)25 ℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为__________,由水电离出的c(OH-)=__________ mol·L-1。
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。理由是__________________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25 ℃) |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为____________________________。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为__________________
(5)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________。
大气中的部分碘源于O3对海水中I-的氧化,将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)ΔH1
②IO-(aq)+H+(aq) HOI(aq)ΔH2
HOI(aq)ΔH2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l)ΔH3
I2(aq)+H2O(l)ΔH3
总反应的化学方程式为____________________,其反应热ΔH=__________。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3—(aq),
I3—(aq),
其平衡常数表达式为______________。
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3—浓度和体系pH,结果见图2和下表。 、
、
| 编号 |
反应物 |
反应前pH |
反应后pH |
| 第1组 |
O3+I- |
5.2 |
11.0 |
| 第2组 |
O3+I-+Fe2+ |
5.2 |
4.1 |
①第1组实验中,导致反应后pH升高的原因是______________________________。
②图1中的A为__________,由Fe3+生成A的过程能显著提高I-的转化率,原因是____________________________________________________________。
③第2组实验进行18 s后,I3—浓度下降,导致下降的直接原因有(双选)________(填字母序号)。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3~18 s内第2组实验中生成I3—的平均反应速率(写出计算过程,结果保留两位有效数字)。