右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是( )
| A.向NaAlO2溶液中滴入HCl至过量 |
| B.向澄清石灰水中通入CO2至过量 |
| C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失 |
配制一定物质的量浓度的某溶液,下列情况,会使配制结果偏低的是 ()
| A.未冷却就转移.定容 | B.未洗涤烧杯和玻璃棒 |
| C.定容时俯视刻度线观察液面 | D.容量瓶未干燥,内有少量水 |
实验室用KClO3和浓盐酸反应制取氯气,化学方程式为()
KClO3+6HCl=KCl+3Cl2↑+3H2O若生成71g氯气,则被氧化的氯化氢
| A.73g | B.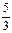 ×36.5g ×36.5g |
C.3×36.5g | D. ×36.5g ×36.5g |
为了使鱼苗顺利运输,必须满足三个条件:(1)需要保持适量氧气;(2)使鱼苗呼出的二氧化碳及时排除;(3)防止细菌大量繁殖。则在远距离运输鱼苗的水中,最好加入适量下列物质中的()
| A.过氧化钠 | B.氯水 | C.石灰水 | D.过氧化钙(CaO2) |
一定温度下,向饱和的NaOH溶液中加入少量的Na2O2固体,充分反应后恢复到原来的室温,下列叙述不合理的是()
| A.NaOH溶液浓度增大,并且放出O2 |
| B.溶液的质量变小,有O2放出 |
| C.NaOH的质量分数不变,有NaOH晶体析出 |
| D.溶液中Na+的物质的量浓度不变,但物质的量减少了 |
2004年4月16日重庆天原化工总厂的氯气贮罐发生泄漏,严重影响了附近群众的生命安全,下列有关安全措施中不正确的是()
| A.可用毛巾蘸取浓NaOH捂嘴防毒 | B.在氯气泄漏的地区人应站在高处 |
| C.向氯气中喷洒含碱性溶液可以消毒 | D.在氯气泄漏的地区撒生石灰 |