某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝、白色沉淀均不溶于稀硝酸。由该实验能得到的正确结论是:( )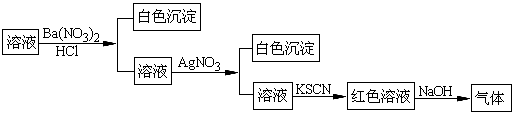
| A.原溶液中一定含有SO42-离子 | B.原溶液中一定含有NH4+离子 |
| C.原溶液中一定含有Cl-离子 | D.原溶液中一定含有Fe3+离子 |
下列操作不正确的是
| A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛 |
| B.制氧气时,用排水法收集氧气出现倒吸现象,立即松开试管上的橡皮塞 |
| C.用蒸馏水润湿了的pH试纸,测得某盐酸溶液的pH为2 |
| D.过滤时用玻璃棒搅拌以加快过滤速度 |
下列每组中的两对物质,都能用分液漏斗的是
| A.葡萄糖和水、汽油和植物油 | B.汽油和水、苯和水 |
| C.食用油和水、酒精和水 | D.汽油和水、四氯化碳和水 |
下列实验操作正确的是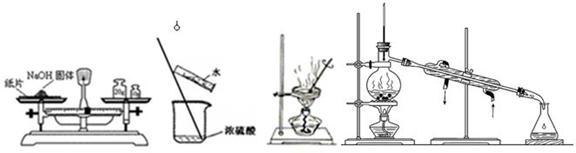
| A.称量氢氧化钠固体 | B.浓硫酸稀释 | C.蒸发 | D.蒸馏 |
某混合盐溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-和x mol SO42-,则x为
| A.0.1 | B.0.3 | C.0.5 | D.0.15 |
下列有关摩尔的使用正确的是
| A.1 mol O的质量为16 g·mol-1 |
| B.0.5 mol He约含有6.02×1023个电子 |
| C.2 H既表示2个氢原子又表示2 mol氢原子 |
| D.每摩尔物质均含有6.02×1023个原子 |