A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
请回答下列问题:做无机推断题找到突破点是关键,A是一种高熔点物质,可知A为Al2O3,D是一种红棕色固体,可知D为Fe2O3,B为O2,C为Al,E为Fe,F为FeCl2,G为Fe(OH)2,J为Fe(OH)3,H为NaAlO2,I为AlCl3。
(1)电解A物质的阳极电极反应式为___________,C与D在高温下反应,引发该反应需要加入的一种试剂是____________________(写化学式)
(2)写出G→J反应的实验现象与化学方程式____________________________________,__________________________________
(3)H 与I反应的离子方程式为___________________________________________
(4)用离子方程式表示I物质能用于净水的原理___________________________________
【化学选修5:有机化学基础】
已知:
有机物A是一种医药中间体,质谱图显示其相对分子质量为130。已知0.5molA完全燃烧只生成3mol CO2和2.5molH2O。A可发生如下图所示的转化,其中D的分子式为C4H6O2,两分子F反应可生成六元环状酯类化合物。
请回答:
(1) A的分子式是。
(2)1mol B与足量的金属钠反应产生22.4L(标准状况)H2。B中所含官能团的名称是。B与C的相对分子质量之差为4,B→C的化学方程式是。
(3) D的同分异构体G所含官能团与D相同,则G的结构简式可能是、。
(4)F可发生多种类型的反应。
①两分子F反应生成的六元环状酯类化合物的结构简式是;
②由F可生成使Br2的CCl4溶液褪色的有机物H。F→H的化学方程式是。
③F在一定条件下发生缩聚反应的化学方程式是。
(5)A的结构简式是。
【化学选修2:化学与技术】工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
已知:①NaHSO4溶解度随温度的升高而增大,适当条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
反应器Ⅰ中发生反应的化学方程式为,冷却的目的是,能用蒸馏法分离出高氯酸的原因是。
(2)反应器Ⅱ中发生反应的离子方程式为。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式:。
某强酸性溶液X含有Ba2+、Al3+、NH+4、Fe2+、Fe3+、CO2-3、SO2-3、SO2-4、Cl-、NO-3中的一种或几种,取该溶液进行连续实验,实验内容如下: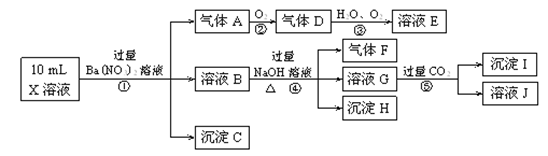
根据以上信息,回答下列问题:
(1)反应③的化学方程式为_________________________________________________。
(2)沉淀C、H和气体F的化学式分别为___________________________________。
(3)写出有关反应的离子方程式:
①中生成A________________________________________________________。
⑤_______________________________________________________________。
(4)上述离子中,溶液X中肯定不含有的离子是________________________________,可能含有的离子是________________________________。
带有支链的某烃A的分子式为C6H14,若烃A的一氯取代物只有3种,分别是B、C、D,且有如下的转化。请回答下列问题: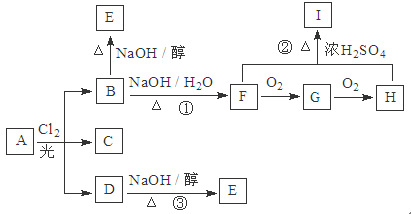
(1)C的名称为________________,G中含有的官能团的名称是______________。
(2)0.1 mol该烃A完全燃烧的产物被碱石灰完全吸收,碱石灰的质量增加__________。
(3)写出下列反应的类型:②_________________;③_________________。
(4)写出D→E的化学方程式_____________________________________________。
(5)H的同分异构体中符合下列条件的共有________种。
①属于酯类化合物;②水解产物含有相同数目的碳原子。
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为;
“滤渣A”主要成份的化学式为。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O="=" 15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为。
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是(几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式)。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |