随着科技的飞速发展,出现了许多新型无机材料,如植入生物体内的生物陶瓷材料HAP[化学式为Cam(PO4)n(OH)2],已被医疗上用于修补人的骨骼和牙组织,HAP的化学式中m等于( )
A. |
B. |
C.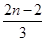 |
D.n+1 |
下列离子方程式书写正确的是
A.向苯酚钠溶液中通入少量CO2: 2C6H5O +CO2+H2O→2C6H5OH+CO32- +CO2+H2O→2C6H5OH+CO32- |
B.NH4HSO3溶液与足量NaOH溶液反应:HSO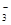 +OH-=SO32-+H2O +OH-=SO32-+H2O |
| C.Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O |
D.H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO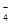 +6H+= +6H+= |
根据原子结构及元素周期律的知识,下列叙述正确的是
| A.由于相对分子质量:HCl>HF,故沸点:HCl>HF |
| B.硅处于金属与非金属的过渡位置,硅可用作半导体材料 |
| C.由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 |
| D.Cl-、S2-、Ca2+、K+半径逐渐减小 |
恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见下表:
| 反应时间/min |
n(MgSO4)/mol |
n(CO)/mol |
n(CO2)/ mol |
| 0 |
2.00 |
2.00 |
0 |
| 2 |
0.80 |
||
| 4 |
1.20 |
下列说法正确的是
A.反应在0~2min内的平均速率为v(SO2)=0.6 mol·L-1·min-1
B.反应在2~4min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
25℃时,向10 mL 0.1 mol·L-1 CH3COONa溶液中加入0.1 mol·L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法正确的是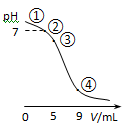
| A.点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) |
| B.点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1 |
| C.点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
下列说法正确的是
| A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)的ΔH<0 |
| B.常温下,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 |
| C.常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| D.等体积、等物质的量浓度的NH3·H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3·H2O的电离程度小于NH的水解程度 |