当前,大量施用氮素化肥是冬小麦获得高产的重要措施之一。
(1)施入土壤的氮素化肥主要以__________________形式被小麦根部吸收,透气性较好的土壤,植物容易吸收氮素化肥,透气性较差的黏质土壤,则根的吸肥力差,这是因为________________________________________________________________________
________________________________________________________________________。
(2)施肥后要及时灌溉,若从麦田流失的水从下图A位置注入一条河流,导致下游水体中藻类和细菌数量发生的变化如下列曲线图所示:
①在A的下游藻类数量增加的原因是______________________________________
________________________________________________________________________。
②在3 km以外的河段,细菌数量迅速增加的原因是
________________________________________________________________________。
③在下游6 km处的河段发现鱼类大量死亡,原因是
________________________________________________________________________。
④在距A 2 km处,水中的氧气含量比A处高,原因是
________________________________________________________________________。
某有机物A的结构简式为:
(1)A与过量的NaOH溶液反应时,A与参加反应的NaOH的物质的量之比是。
(2)A与新制Cu(OH)2反应时,A与被还原的Cu(OH)2的物质的量之比是。1molA最多能消耗mol Cu(OH)2。
(3)A与过量的NaHCO3反应时,A与NaHCO3的物质的量之比是。
已知:①R—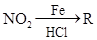 —
—
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图: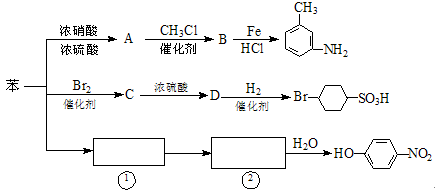
(1)A转化为B的化学方程式是_______________________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________________,②____________________________。
(3)B在苯环上的二氯代物有种同分异构体。
(4)有机物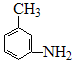 的所有原子(填“是”或“不是”)在同一平面上。
的所有原子(填“是”或“不是”)在同一平面上。
已知某有机物的结构简式为:
(1)该有机物中所含官能团的名称是_______________________________。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为______________。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):
___________________________________________________
今有A、B、C三种二甲苯;将它们分别进行一硝化反应,得到产物分子式都是C8H9NO2,但A得到两种产物,B得到三种产物,C只得到一种产物。由此可判断A、B、C是下列哪一种结构,请将字母填入结构式后面的括号中。 ()
()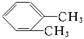 ()
() ()
()
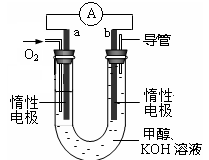
(16分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g)△H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g)≒CH3OH(g)△H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。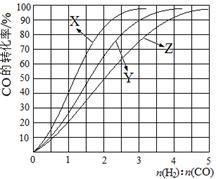
|
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母)。
A.1~1.5 B.2.5~3C.3.5~4.5 H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题: