Ⅰ:某些化学反应可表示为:A+B→C+D+H2O,请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,该反应离子方程式为 。
(2)若A为淡黄色固体,C为无色的气体,则该反应的离子方程式为 。
(3)若A、C、D均是铁的化合物,B是稀硫酸,则A与B反应的化学方程式为 。
Ⅱ:某些化学反应可表示为:A+B+H2O→C+D。请回答下列问题:
(1)若A为非金属单质,C为非金属单质,写出符合要求的化学反应方程式
(2)若A为金属单质,C为非金属单质,写出符合要求的离子方程式_____________________.
氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为 ▲。氧元素与氟元素能形成OF2分子,该分子的空间构型为 ▲。
(2)根据等电子原理,在NO2+离子中氮原子轨道杂化类型是 ▲;1 mol O22+中含有的π键数目为 ▲。
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr3+基态核外电子排布式为 ▲。
(4)钙在氧气中燃烧时得到一种钙的氧化物晶体,其晶体结构;如图所示,则该钙的氧化物的化学式为 ▲。
用广谱高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,在该反应中NaClO3和Na2SO3的物质的量之比为 ▲。
(2)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是 ▲。
(3)化学小组的同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他们进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001000 mol·L-1 AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是 ▲。
②已知Ksp(AgCl) = 1.78×10-10,Ksp(Ag2CrO4) = 2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.000×10-3 mol·L-1 。试计算此时溶液中Cl-的浓度是多少。
。试计算此时溶液中Cl-的浓度是多少。
紫草宁具有多种生物活性,能抗菌、消炎、抗肿瘤等。合成紫草宁的部分工艺流程如下: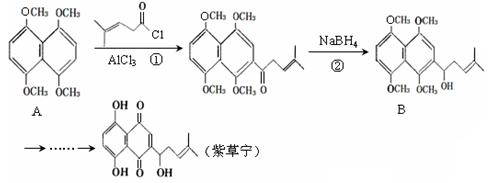
(1)紫草宁中的含氧官能团的名称是 ▲,它含有 ▲个手性碳原子。
(2)反应①、②的反应类型分别是 ▲、 ▲。
(3)A中含有萘环结构,M与A互为同分异构体,且符合下列条件:(a)M也含有萘环结构,且环上的一氯取代物只有一种;(b)1 mol M能与足量的金属钠反应生成2 mol H2;(c)M不能与Na2CO3溶液反应。
则M可能的结构简式为 ▲(任写一种)。
(4)B能发生消去反应,该反应的化学方程式为 ▲。
(5)结 合题给信息,写出由苯、乙酰氯(结构简式如右图)制备聚苯乙烯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
合题给信息,写出由苯、乙酰氯(结构简式如右图)制备聚苯乙烯的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: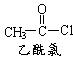
从废钯催化剂(该催化剂的载体为 活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下:
活性炭,杂质元素有铁、镁、铝、硅、铜等)中提取海棉钯(含Pd>99.9%)的部分工艺流程如下: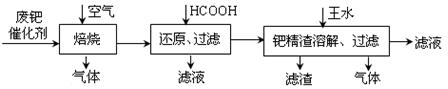
将最后所得到的滤液,经过一定的操作后可得到海棉钯。
(1)废钯催化剂经烘干后,再在800℃的高温下焙烧,焙烧过程中需通入足量空气的原因是 ▲;焙烧时钯转化为氧化钯(PdO),则甲酸还原氧化钯的化学方程式为 ▲。
(2)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯精渣的适宜条件为 ▲、 ▲、 ▲。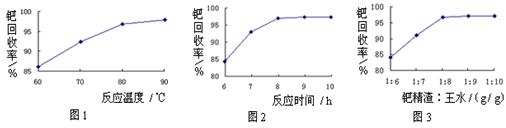
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,王水溶解钯精渣的过程中有化合物A和一种无色、有毒气体B生成,并得到滤渣。
①气体B的分子式: ▲;滤渣的主要成分是 ▲。
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%,则A的化学式为 ▲。
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对 燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 ▲。
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) 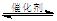 CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800  K K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①若温度升高,则反应的平衡常数K将 ▲(填“增大”、“减小”或“不变”。下同);若温度不变,提高投料比[n(H2) / n(CO2)],则K将 ▲。
②若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式
▲。
③在②所确定的电池中,若通入甲醚(沸点为-24.9 ℃)的速率为1.12 L·min-1(标准状况),并以该电池作为电源电解2 mol·L-1 CuSO4溶液500 mL,则通电30 s后理论上在阴极可析出金属铜 ▲g。