在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是( )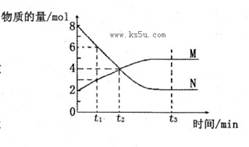
A.反应的化学方程式为:2 M N N |
| B.t1时,N的物质的量浓度是M物质的量浓度的2倍 |
| C.t2时,正逆反应速率相等,达到平衡 |
| D.t3时,正反应速率大于逆反应速率 |
下列关于水的说法正确的是
| A.我们平时应多饮用很纯净的水,防止有毒物质进入体内 |
| B.所有天然水都不能饮用 |
| C.人体内含有约2/3体重的水,故人每天不用喝水也可 |
| D.人体需要不断补充水分,每人每天需要补充2.5~4 L水 |
关于平衡膳食宝塔的认识中,正确的是
| A.塔底的食物最重要 |
| B.塔顶的食物最重要 |
| C.膳食宝塔所列食物摄入量对任何人都是最佳摄入量 |
| D.膳食宝塔所列食物摄入量是每人每日的建议摄入量,具体到不同的个体要根据自身的情 |
况而调整
鉴别织物成分是真蚕丝还是“人造丝”,在如下①-④的各方法中正确的是
①滴加浓硝酸②滴加浓硫酸③滴加酒精④灼烧
| A.①和③ | B.③和④ | C.①和④ | D.①和② |
为了增加汽车轮胎的耐磨性,常在轮胎的橡胶中加入的耐磨物质是
| A.石墨粉 | B.活性炭 | C.炭黑 | D.木炭粉 |
坏血病是由哪一种维生素缺乏引起的
| A.维生素K | B.维生素B1 | C.维生素C | D.维生素B12 |