实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,消耗NaOH溶液的体积(mL) |
待测盐酸溶液的体积(mL) |
| 1 |
0.10 |
22.02 |
20.00 |
| 2 |
0.10 |
22.00 |
20.00 |
| 3 |
0.10 |
21.98 |
20.00 |
(1)滴定达到终点的现象是 ;此时锥形瓶内溶液的pH的范围是 。
(2)根据上述数据,可计算出该盐酸的浓度为 。
(3)排去碱式滴定管中气泡的方法应采用右图的 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成
测定结果(待测液浓度值)偏高的有 (漏选得1分,错选、多选得0分):
A. 配制标准溶液定容时,加水超过刻度
B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用待测稀盐酸溶液润洗
D. 滴定到达终点时,仰视读出滴定管读数;
E. 碱式滴定管尖嘴部分有气泡,滴定后消失
下面列出了几组物质,请将物质的合适组号填写在空格上。
① 氧气(O2)与臭氧(O3); ②16O、17O和18O; ③ CH4和CH3CH2CH3;
④ ⑤(CH3)2CHCH2CH3 和C(CH3)4
⑤(CH3)2CHCH2CH3 和C(CH3)4
(1)同位素;(2)同种物质;(3)同分异构体;(4) 同系物。
胃酸过多可服用Al(OH)3胶囊或NaHCO3粉剂等进行治疗,试写出它们分别和胃酸的主要成分HCl反应的离子方程式:、
,但如果胃部已出现溃疡,则不可服用上述两种制剂中的 (填写物质的化学式) 。
(1)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的作用之一是使CO与NO反应,生成两种无毒气体,试写出CO与NO反应的化学方程式:。
(2) 经研究,光化学烟雾的有害物质中含有臭氧,其形成过程与二氧化氮有关,这个过程实际上包含了三个反应:①NO2 NO+O、②2NO+O2= 2NO2、③O2+O = O3。则总反应可表示为,NO2在其中起了作用。
NO+O、②2NO+O2= 2NO2、③O2+O = O3。则总反应可表示为,NO2在其中起了作用。
现有下列五种物质:
| A.食盐 | B.食醋 | C.苹果汁 | D.葡萄糖 E.青霉素,请按下列要求填空(填序号,每空只填一个):富含维生素C的是;可直接进入血液,补充能量的是;应用最广泛的抗生素之一的是;既可作为食品酸味调味剂,又可作为防腐剂的是;食用过多会引起血压升高、肾脏受损的。 |
某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O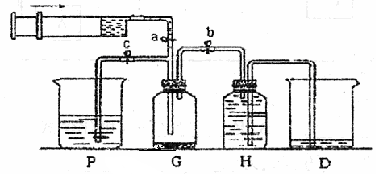
试回答下列问题:
(1)在反应2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O中,HCl体现的性质为________和_________.当生成的Cl2的体积5.6L(标准状况下),求转移的电子的个数________(阿伏伽德罗常数用NA来表示)
(2)装置H中盛放的试剂是。装置P中盛放的试剂是。
(3)尾气处理时关闭弹簧夹a和弹簧夹,打开弹簧夹。
(4)处理尾气时,发生反应的离子方程式为。