过氧化氢(H2O2)俗名双氧水,医疗上可做外科消毒剂。
(1)H2O2的电子式为______。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫色消褪了,此时双氧水表现出_______性。若MnO4-的产物为Mn2+,该反应的离子方程式为______。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关的反应方程式为______。此时双氧水表现出______性。
6分)下列物质:①固体烧碱 ②HCl气体 ③SO3 ④CCl4⑤石墨 ⑥浓硫酸
⑦液态醋酸 ⑧碳酸钙⑨熔融KCl中,(填编号,下同)
属于强电解质的是 ,属于非电解质的是
,属于非电解质的是 ,
,
能导电的是
T1℃时,向容积为2L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g) +H2O(g)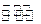 CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2> t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2> t1):
(1)用H2表示反应在t1min内的平均速率为v(H2)= ________________。
(2)保持其他条件不变,若起始时向容器中充入1.50m olCO和1.00molH2O(g),达到平衡时,n(CO2)=________________。
(3) 保持其他条件不变,在t2时向容器中再通人0.50molCO,与原平衡相比,达到新平衡时CO转化率将________________(填增大或减小,下同),H2O的体积分数将 ______。
保持其他条件不变,在t2时向容器中再通人0.50molCO,与原平衡相比,达到新平衡时CO转化率将________________(填增大或减小,下同),H2O的体积分数将 ______。
(4)保持其他条件不变,若起始时向容器中充入amolCO和bmolH2O(g),达到平衡时,CO2的体积分数为24 %,a、b的值须满足的条件是________________。
(5)温度升至T2℃,上述反应的平衡常数为0.64,则正反应的△H____ 0(填>或<)。
下图为某套实验装置示意图,无法看到实验说明,加热装置已经省略。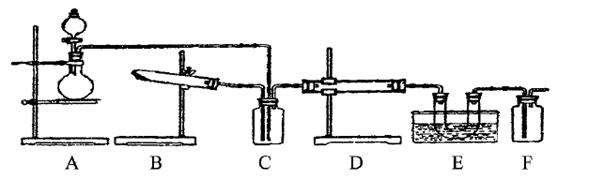
I.甲同学认为当D处盛放V2 O5作催化剂时,此套装置可用于合成物质X,并预测E处冰水冷却的U型管中将有固体X出现。
(1)事实上此装置所附实验说明符合甲同学的推断,那么A中所发生的反应的化学方程式是________________,C装置中盛放的液体药品的名称是________________。
(2)甲同学方案中为了提高A装置产物的转化率,可以增大B装置产物的通入量,欲知A、B两装置中产物在D中的通入量,可通过观察________________得知。
(3)本实验在设计上有无缺失之处?若有请答出改进方案________________;(若无,此问可不答
II.乙同学认为若D处盛放铂铑合金网作催化剂,则此套装置也可用于合成物质Y,并预测E处冰水冷却的U型管中将有红棕色气体生成,且越接近U型管底部颜色越浅。
(4)写出乙同学认为的D装置中发生反应的化学方程式。
(5)对于A处,乙认为没有加热装置,请代乙阐述A中气体的产生原理。
(6)若要用上述装置完成乙同学所认为的实验,且C处所起作用与合成X时所起作用基 本一致,那么C处的广口瓶应改为________________,所装药品为________________。
在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。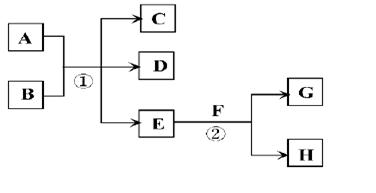
回答下列问题:
(1)在反应②中,每生成2.24L气体G(标准状况)时,该反应转移电子的物质的量是________________。
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则反应①的离子方程式是________________。
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是________________。 (4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是________________。
(4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是________________。
(5)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是________________。
X、Y、Z、R、T是原子序数依次增大的短周期主族元素,X、R在周期表中的相对位置如右表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数;Z是地壳中含量最多的金属元素。
(1)X的最高价氧化物的电子式是_________,元素T在周期表中的位置是________________。
(2)Z和T形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为________________。
(3)Y的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(4)已知由X和R形成的液态化合物XR2的燃烧热是1075 kj/mol,试写出表示其燃烧热的热化学方程式________________