反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )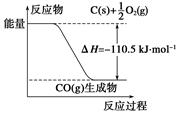
| A.12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ |
| B.该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ |
| C.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ |
| D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
已知废旧干电池中的填充物主要有二氧化锰、炭黑、氯化锌、氯化铵、淀粉糊、Mn2O3、ZnO、FeO、汞的化合物等。某实验小组的同学拟回收废旧电池中的部份物质,主要操作流程如下图:
下列说法不正确的是
| A.步骤①②的名称分别为溶解、过滤 |
| B.步骤③中使用的化学仪器有酒精灯、三角架、泥三角、坩埚、玻璃棒 |
| C.步骤①②③中都使用了玻璃棒,且三个操作中玻璃棒的作用不完全相同 |
| D.步骤④的离子方程式为2Fe2++2H++H2O2 = 2Fe3++2H2O |
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.0.1mol OD- 离子含有的质子、中子数均为1.0NA OD- 离子含有的质子、中子数均为1.0NA |
| B.含有4.6 g钠元素的过氧化钠和氧化钠的混合物中,所含离子总数为0.3NA |
| C.3.6 g石墨中,含有共价键数为0.3NA |
| D.标准状况下,4.48 L己烷含有的分子数为0.2NA |
生活中处处有化学,下列表述不正确的是
| A.福尔马林可作食品的保鲜剂 |
| B.聚乙烯塑料制品可用于食品的包装 |
| C.碳酸氢钠可作胃酸的中和剂 |
| D.食盐可作调味剂,也可作食品防腐剂 |
下列说法正确的是
| A.将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,下层溶液呈紫红色,说明氧化性:Br2>Fe3+>I2 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量 |
C.常温下,0.1 mol·L-1某一元酸HA溶液中 =1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 =1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 |
| D.取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,不能说明Na2O2是否变质 |
下列有关图示分析正确的是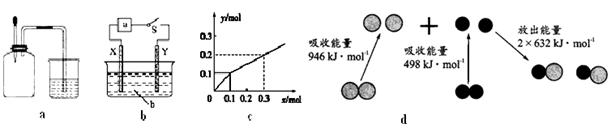
| A.如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 |
| B.如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a |
| C.Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ |
| D.图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=—180 kJ/mol |