不管化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1①
C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1②
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1③
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
| A.(Q1+Q2+Q3) kJ | B.[0.5(Q1+Q2+Q3)] kJ |
| C.(0.5Q1-1.5Q2+0.5Q3) kJ | D.(1.5Q1-0.5Q2+0.5Q3) kJ |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为
CO(g)+ H2O(g)  CO2(g) + H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
CO2(g) + H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
| A.增加压强 | B.降低温度 | C.增大CO 的浓度 | D.更换催化剂 |
下列有关说法正确的是
| A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
| B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
C.CH3COOH 溶液加水稀释后,溶液中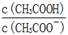 的值减小 的值减小 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
下列离子方程式 错误的是
| A.向Ba(OH)2溶液中滴加稀硫酸: Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O |
| B.酸性介质中KMnO4氧化H2O2: 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| C.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合: NH4++Al3++SO42-+Ba2++4OH-= BaSO4↓+Al (OH)3↓+NH3·H2O |
| D.铅蓄电池充电时的正极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1一定条件下,向体积为1L的恒容密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1一定条件下,向体积为1L的恒容密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是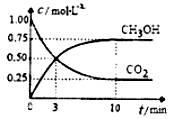
| A.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| B.从反应开始到平衡,H2的平均反应速率v(H2)="0.225" mol·L-1·min-1 |
| C.13min时,向容器中充入 2mol氦气,该反应的化学反应速率增大 |
| D.13min时,向容器中充入 2mol CO2,该反应化学平衡常数增大 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,22.4 L已烷中含已烷分子数目为NA |
| B.28g 由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA |
| C.71g Na2SO4固体中含钠离子数目为NA |
| D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA |