某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,
尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
| 实 验 用 品 |
溶 液 温 度 |
中和热 △H |
|||
| t1 |
t2 |
||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。计算完成上表。
(4)实验中NaOH的浓度比HCl的大,其原因是
(5)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,则测定结果 (填“偏高”“偏低”或“无影响”)。
1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
| H:2.1 |
||||||
| Li:1.0 |
Be:1.5 |
B:2.0 |
C:2.5 |
N:3.0 |
O:3.5 |
F:4.0 |
| Na:0.9 |
Mg:1.2 |
Al:1.5 |
Si:1.8 |
P:2.1 |
S:2.5 |
Cl:3.0 |
| K:0.8 |
Ca:1.0 |
Ga:1.6 |
Ge:1.8 |
As:2.0 |
Se:2.4 |
Br:2.8 |
| Rb:0.8 |
Sr:1.0 |
In:1.7 |
Sn:1.8 |
Sb:1.9 |
Te:χ |
I:2.5 |
| Cs:0.7 |
Ba:0.9 |
Tl:1.8 |
Pb:1.9 |
Bi:1.9 |
Po:2.0 |
At:2.2 |
| Fr:0.7 |
Ra:0.9 |
回答下列问题:
⑴纵观各周期主族元素电负性变化,谈谈你对元素性质呈现周期性变化的理解:;
⑵预测Te元素χ的值;
⑶你认为Linus Pauling提出电负性的概念是确定化合物中原子哪种能力的相对大小?;
⑷大量事实表明,当两种元素的电负性差值小于1.7时,这两种元素通常形成共价化合物。用电子式表示AlBr3的形成过程。
(本题共13分)以下两个化学实验是某小组的同学对海水中化学资源的探究活动。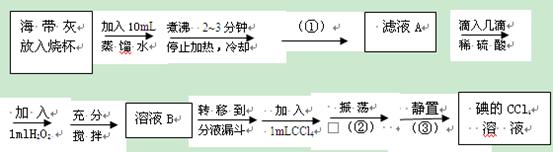
(一)从海带灰中提取碘
从海带灰中提取碘的实验流程如下:
(1)实验流程中,括号里①②③表示的是操作方法,请填写:
①②③
(2) 实验流程中,“煮沸2~3分钟”主要作用是。
(3)实验流程中,“滴加稀硫酸和加入H2O2”主要作用是______________。
(二) 测定卤水中硫酸镁的含量
用海水制盐,分离出食盐后的卤水,主要含有氯化钠和硫酸镁。测定卤水中硫酸镁含量的实验步骤如下:
①量取该卤水样品100mL。
②取用一定物质的量浓度的氢氧化钠溶液100mL,平均分四次依次加入到该100mL卤水样品中,充分振荡。
③每次实验所得数据见下表
 |
1 |
2 |
3 |
4 |
| 加入氢氧化钠溶液的体积/mL |
25 |
25 |
25 |
25 |
| 生成沉淀的总质量/g |
0.29 |
X |
0.87 |
0.87 |
请回答
(4)请写出实验过程中所涉及到的反应离子方程式____________________。
(5)上表中X是因为实验过程中漏记了数值,你推测X的数值为_____。
(6)实验中所用到的氢氧化钠溶液物质的量浓度为_______________。
(7)100mL卤水中含硫酸镁的质量是_________g
(本题共9分)化学能在一定的条件下可以转化为电能。
(一)现有如下两个反应:
① 2FeCl3 + Cu = 2FeCl2 + CuCl2
② Na2CO3 + 2HCl =" 2NaCl" + H2O + CO2↑
(1)根据两个反应的本质判断,您认为可以设计成原电池的是(填反应序号),理由是。
(二)请根据Zn + CuSO4 = ZnSO4 + Cu反应,选择适宜的材料和试剂设计一个原电池。
(2)画出原电池装置图,并在图中标注出电极和电解质溶液的名称。
(3)写出该原电池电极反应式:正极:;负极:。
(本题共8分)实验对认识和研究物质性质有重要作用,回答下列相应问题。
(一)为证明Na2SiO3具有防火性能,同时做以下两个实验。
实验①:取一小木条,放入蒸馏水中,使之充分吸湿、浸透,取出稍沥干(不再滴液)后,放置在酒精灯外焰处。
实验②:另取一个相同的小木条,放入Na2SiO3饱和溶液中,之后重复实验①的操作。
(1)设计实验①的目的是。
(二)性质实验中反应原理常用化学方程式表示。请用化学方程式各举一例,说明下列物质所具有的性质。
(2)SO2具有还原性。
(3)SO2具有酸性氧化物共同的性质。
(4)浓硫酸具有强氧化性。
(本题共10分)有A、B、C、D、E、F六种元素。
①A、B、C是金属元素,位于同一周期,原子核外都有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F的单质在常温下是气体,性质很稳定,是除氢外最轻的气体。
请回答:
(1)B位于周期表中第________周期______族,C的原子结构示意图是________。
(2)F单质的化学式是________。
(3)在上述六种元素中,最高价氧化物对应的水化物碱性最强的物质是_____,酸性最强的物质是________,气态氢化物最稳定的是________。