运用有关原理,回答下列问题:(共计10分)
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(H+)= ,用离子方程式表示CH3COONa溶液呈碱性的原因: 。
(2)已知NaHSO4在水中的电离方程式为NaHSO4===H++ SO42-+Na+。在NaHSO4溶液中,c(H+) c(OH-)+ c(SO42-)(填“﹤”“﹥”或“=”,下同);室温下用NaHSO4溶液与Ba(OH)2溶液制取BaSO4,若溶液中的SO42-完全沉淀,则反应后溶液的pH 7。
(3)已知Ksp(BaSO4)=1.1×10-10。将等体积的Na2SO4溶液和BaCl2溶液混合,若Na2SO4溶液的浓度为0.02mol/L,则生成BaSO4沉淀所需的BaCl2溶液的最小浓度为 。
(忽略溶液混合时体积的变化)
250 ℃时将24.8 g NaOH和NaHCO3的混合物放在密闭容器中加热,充分反应后,称得剩余固体的质量为23 g。请回答:
(1)NaOH和NaHCO3的物质的量之比________________1(填“>”“<”或“=”)。
(2)NaOH的物质的量为______________________________。
已知单质铁溶于一定浓度的硝酸溶液中,反应的离子方程式为:
aFe+bNO +cH+
+cH+ dFe2++fFe3++g NO↑+hN2O↑+kH2O(化学计量数均为正整数)。回答下列问题:(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示。下同)。
dFe2++fFe3++g NO↑+hN2O↑+kH2O(化学计量数均为正整数)。回答下列问题:(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是(用一个代数式表示。下同)。
(2)根据反应中离子电荷守恒,可得b、c、d、f的关系式是。
(3)根据反应中电子转移的总数相等,可得d、f、g、h的关系式是,若a等于12,且铁和稀硝酸恰好完全反应,则b的取值范围是,c的取值范围是。
A是氮、氢两种元素组成的化合物,它和氨气与H2O2和H2O之间在结构上的关系相似。A分子中N和H的质量比为7∶1。请填写以下空白:
(1)A的化学式为__________。
(2)A的水溶液呈__________(填“酸”“碱”“中”)性,1 mol A最多可以与__________mol HCl(或NaOH)发生反应生成正盐,写出生成的盐中含有氮原子的离子的电子式:__________
__________________________________。
(3)A在氧化还原反应中也与H2O2相似,既可作氧化剂,也可作还原剂。根据价态分析产生这种情况的原因:_____________________________________________________________。
现有物质A、B、C、D、E、F、G、H、M、N,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示的变化(其他有关反应条件均略去)。试完成下列问题: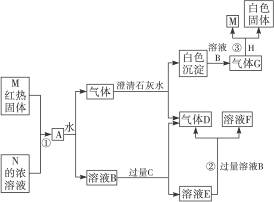
(1)写出C、D、H的化学式___________、___________、___________。
(2)写出反应①②③的化学方程式:
①_______________________________________________,
②_______________________________________________,
③_______________________________________________。
有四种无色溶液A、B、C、D,它们分别是BaCl2、(NH4)2SO4、NaOH、NH4NO3溶液中的一种。将A和B、B和C共热,都产生能使湿润的红色石蕊试纸变蓝的气体;C和D混合无反应现象;A和D混合则有白色沉淀生成。
(1)试判断四种溶液中A是__________,B是__________,C是__________,D是__________。
(2)写出A+B和A+D反应的离子方程式。