Ⅰ、实验室常用以下方法制取氯气:MnO2+ 4HCl(浓)  MnCl2+Cl2↑ + 2H2O,
MnCl2+Cl2↑ + 2H2O,
(1)用双线桥标出电子转移方向和数目。(在答题纸上标)
(2)在标准状况下生成的Cl2为11.2L时,参加反应的HCl的物质的量为 ,
被氧化HCl的质量为 。
Ⅱ、科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒。这是因为
对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化
合物。通过以上信息填空:
(1)维生素C具有 (填氧化性或还原性)。
(2)上述过程中+5价砷类物质作为 (填氧化剂或还原剂),+5价砷元素发生
反应(填氧化或还原);2mol +5价砷完全转化为 +3价砷,共转移 个
电子(用NA表示阿伏加德罗常数)。
(1)下列五种物质中①Ar、②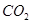 、③
、③ 、④NaOH、⑤
、④NaOH、⑤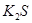 ,只存在共价键的是(填序号,下同),只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。
,只存在共价键的是(填序号,下同),只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。
(2)在以下过程中:①碘的升华、②烧碱熔化、③氯化铵受热分解、④石英熔化、⑤氯化钠溶于水、⑥氯化氢溶于水、⑦氧化钠溶于水、⑧碘溶于四氯化碳,未发生化学键破坏的是
(填序号,下同),仅发生离子键破坏的是,仅发生共价键破坏的是,既发生离子键破坏、又发生共价键破坏的是。
A、B、C、C、E是含有一种相同元素的五种物质,可发生如下转化关系:其中A是一种淡黄色粉末固体单质;B是气态氢化物;C、D是氧化物;E是该元素最高价氧化物对应的水化物。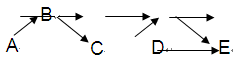
(1)元素A在元素周期表中的位置为。
(2)B的名称是。
(3)写出C的一种用途;
C的水溶液在空气中放置一段时间后溶液的pH减少,试说明其原因
。
(4)D溶于水发生反应的离子方程式。
(5)E的浓溶液与碳单质反应的化学方程式。
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④的最简单氢化物的电子式为,结构式。
(2)③、⑦、⑧的最高价含氧对应的水化物的酸性最强的是(填化学式)。
(3)④、⑥、⑦的原子半径由小到大的顺序为。
(4)由①、②、③、④四种元素可形成多种既含有离子键又含有共价键的化合物,写出其中一种化合物的化学式。
(5)元素③和元素⑧的氢化物极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,互相靠近时,可看到大量的白烟,写出产生该现象的化学方程式是。
(6)用电子式表示②的最高价氧化物的形成过程:。(7)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体X,其结构中原子的排列为正四面体,请写出X及其同素异形体的名称、。
将51.2 g铜恰好完全溶于V mL 10 mol/L硝酸中得到硝酸铜溶液,收集到氮的氧化物(含NO、NO2、N2O4)的混合物共17.92 L(标准状况),这些气体恰好能被500 mL
2.0 mol/L NaOH溶液完全吸收,得到500 mL(假设吸收气体后溶液体积不变)钠盐溶液。
发生的反应有: N2O4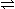 2NO2
2NO2
NO+NO2+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
通过计算回答下列问题:
(1)硝酸铜溶液中硝酸铜的物质的量为________________,V=________。
(2)上述钠盐溶液中硝酸钠的物质的量浓度为______________________。
(3)向上述硝酸铜溶液中加入足量的稀硫酸,再加入足量铜粉,有W g铜完全溶解,将收集到的气体(只有NO生成)全部收集于一试管中,并将充满该气体的试管倒立于盛水的水槽里,再向试管里充入一定量的氧气,最终恰好使溶液充满试管。
①W=______________。②通入的氧气在标况下的体积为______________。
有一纯净的亚硫酸钠晶体因部分被氧化而变质,为了测定样品中杂质的质量分数进行以下实验过程,按要求填写空格:
(1)向混合溶液中加入的无色溶液A是____________(填化学式),A必须过量的原因是
________________________________________________________________________.
(2)白色沉淀c中含有____________________(填化学式).
(3)无色溶液B通常是_____________(填试剂名称),加入后与c反应的离子方程式为
________________________________________________________________________.
(4)通过以上测定可得到样品中杂质的质量分数的计算式为_______________________.