用18mol/L的浓硫酸配制100mL 1mol/L硫酸,
①量取浓硫酸的体积应为 mL,用量筒量取浓硫酸缓缓倒入盛水的烧杯中后, (填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
②若实验仪器有:A.100mL量筒 B.托盘天平 C. 玻璃棒 D. 50mL容量瓶
E. 10mL量筒 F. 胶头滴管 G. 50mL烧杯 H. 100mL容量瓶实验时应选用的仪器有(填入编号,下同) 。
③定容时,若俯视液面,则所配溶液浓度 (填“偏高”、 “偏低” 或“无影响”)
若不小心加水超过了容量瓶刻度线,应 。
A.用胶头滴管将多余溶液吸出 B.加热容量瓶使水挥发 C.重新配制
(每空2分,共4分)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式:___________。已知H2O(l) = H2O(g) ΔH = +44 kJ·mol-1,则标准状况下33.6 L H2生成液态水时放出的热量是kJ 。
(每空1分,共7分)下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)⑤和⑧的元素符号是_________和__________;
(2)表中最活泼的金属是_________,非金属性最强的元素是_________;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是______,分别写出该元素的氢氧化物与⑥、⑨
的最高价氧化物对应水化物反应的化学方程式__________________________________;
__________________________________.
【化学—选修有机化学】
根据下列有机化合物,回答问题。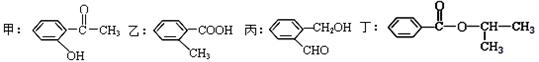
(1)上述互为同分异构体的化合物为;
(2)写出丙中官能团的名称;
(3)丁在一定条件下,可以发生水解反应,生成X、Y两种物质(相对分子质量:X<Y)。由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。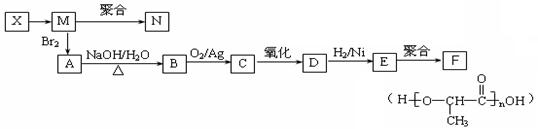
①X转化为M的反应类型是。
②写出B转化为C的化学方程式;
③C与新制氢氧化铜反应的化学方程式为:。
④在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为。
⑤写出3种含有一个羟基、一个酯基的E的同分异构体的结构简式:
、、
(15分)图1是 、
、 、
、 、
、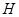 、
、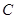 、
、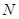 等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是
等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。 (1)图中d的单质对应元素原子的电子排布式是
(2)单质a、b、f对应的元素以原子个数比1:1:1形成的分子中含个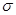 键,个
键,个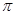 键。
键。
(3)a与b的元素形成的10个电子中性分子X的空间构型为;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成d元素的离子化学式为,其中X与d 高价离子之间以键相结合。
(4)图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:。
(5)图中C单质的晶体堆积方式类型是,这种堆积方式晶胞中原子的配位数为。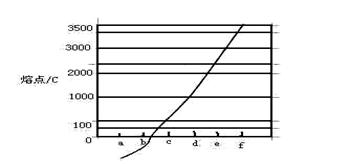
图1图2
【化学一选修2化学与技术】
已知:①工业上用硫酸与锂辉矿(LiA1Si2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用β锂辉矿与硫酸等物质制备金属锂的工业流程如下: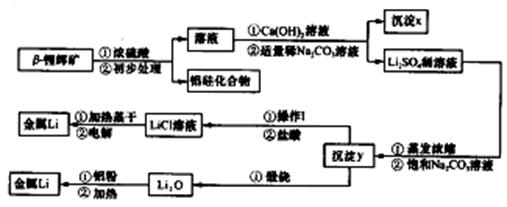
请回答:(1)沉淀y的主要成分的化学式是。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其浓度不同的原因是。
(3)操作I涉及的实验方法是。
(4)写出用铝粉还原法制取金属锂的化学方程式。
(5)LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是。
(6)目前电池通常使用金属锂的优点是。