(Ⅰ)某无色溶液中可能含有Na+、SO42— 、MnO4—、 、Cl— 、Br—、中的若干种,依次进行下列实验。观察到现象如下:
、Cl— 、Br—、中的若干种,依次进行下列实验。观察到现象如下:
①用pH试纸检验,溶液pH>7;
②向溶液中滴加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;
③向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
④另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
回答下列问题:
(1)溶液中肯定含有的离子是 ;肯定没有的离子是 。
⑵写出步骤②中的离子方程式 。
(Ⅱ)SO2气体通入滴有酚酞的NaOH溶液,红色逐渐褪去,可能的原因:
① ② 。
简述设计实验证明: 。
某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表: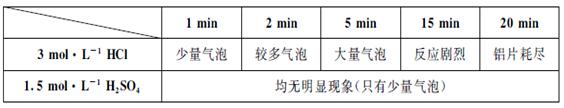
(1)写出铝片与盐酸、硫酸反应的离子方程式
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,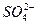 对该反应不影响。
对该反应不影响。
假设二:。
假设三:。]
假设四:。
③请你以“假设一”为实验课题,设计实验方案探究,要求写 出主要实验步骤。
出主要实验步骤。
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。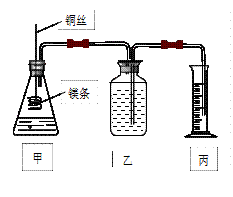
图1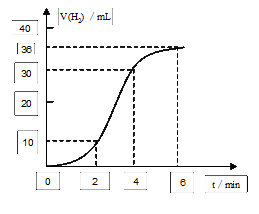
图2
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
|
在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:_______________________________________________________
_________________________________________________________。 率是否变化。
率是否变化。
 论:Cl-对反应具有加速作用。
论:Cl-对反应具有加速作用。
如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液.在F极附近显红色。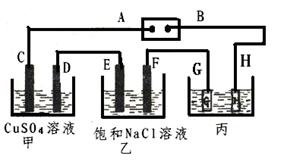
试回答以下问题:
(1)电极A的名称是。
(2)甲装置中D电极的电极反应式: ______________________________。
(3) 在25℃时若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生5.6L(标准状况下)一种气体,电解后溶液体积为50L时,求所得溶液在25℃时的氢氧化钠物质的量浓度=________。
(4)欲用丙装置给铜镀银,G应该是____(填“银”或“铜”),电镀液的主要成分是(填化学式)。
实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案。请回答下列问题。
(1)操作①可选择__________仪器。
(2)试剂1为__________(填化学式)
(3)加入试剂2的目的________________,此时发生反应的离子方程式:______________。
(4)加入盐酸时,所发生反应的离子方程式:_________________________________。
(Ⅰ)气体制备时须先检查装置的气密性,下列各图所示装置,肯定不符合气密性检查要求的是 。
(Ⅱ)下面是中学化学实验中常见的几种仪器:
a.量筒 b.容量瓶 c.分液漏斗 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填编号)。
(2)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
(3)使用前要检查仪器是否漏液的是 (填编号)。
(Ⅲ)实验室需要95 mL 1.0 mol·L-1稀硫酸,现用98%的 浓硫酸(其密度为1.84 g/mL)来进行配制。若实验仪器有:
浓硫酸(其密度为1.84 g/mL)来进行配制。若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒D.250 mL容量瓶
mL量筒 B.托盘天平 C.玻璃棒D.250 mL容量瓶
E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
A.将稀释的硫酸液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.未冷却至室温就定容。 D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
E.容量瓶使用时未干燥
F.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线