恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生反应: N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a= 。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量= 。
(3)原混合气体与平衡混合气体的总物质的量之比n(始)∶n(平)= 。
(4)原混合气体中,a∶b= 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)= 。
今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20,且a+b+c=25;②元素Z的原子价电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z氯化物的相对分子质量之比为38︰77。回答下列问题:
(1)Z的价电子排布图为:。
(2)X2Y2的电子式,该晶体中含微粒间的作用有:。
(3)Y的最常见氢化物的VSEPR模型为, 其中Y原子以 杂化轨道成键;Z的氯化物的分子空间构型是;根据原子轨道成键方式分,Z的硫化物分子中含有的键的种类及数目是 、。
写出符合下列条件的一种微粒的化学式:
(1)两核18电子的分子___________,两核18电子的阴离子______________。
(2)五核10电子的分子___________,五核10个电子的阳离子____________。
在下列物质中:①SiO2 ②NaOH ③Na2S ④H2O2 ⑤Na2O2 ⑥(NH4)2S ⑦CO2 ⑧CCl4 ⑨C2H4 ⑩金刚石.用序号填空:
(1)只含有离子键的是_____;
(2)既含有离子键,又含有极性共价键和配位键的是 _____;
(3)既含有离子键又含有非极性共价键的是 _______;
(4)含有极性共价键和非极性共价键的非极性分子是 _____;
(5)含有极性共价键和非极性共价键的极性分子是 _________;
(6)熔化时只破坏极性共价键的是_______
回答下列问题:
I①~⑨是几种有机物的名称或化学式:
①2,2,3-三甲基丁烷、②3-甲基-1-氯戊烷、③甲苯、④ 、⑤ClCH=CHCl、
、⑤ClCH=CHCl、
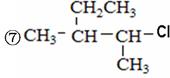


据此回答下列问题:
(1)用系统命名法命名有机物⑧和⑨:⑧_____________,⑨_____________。
(2)上述有机物中,互为同分异构体的是____________(用编号表示),互为同系物的是______________(用编号表示),存在顺反异构的是_______(用编号表示)。
(3)③苯环上的二氯代物有__________种,以该有机物为原料制备TNT炸药的化学方程式为_______
(4)丁基橡胶是④与2-甲基丙烯共聚生成。写出该橡胶的结构简式
II.根据官能团对性质有决定作用,基团对性质有影响作用,完成下列排序:


①上述三种物质溶解性由大到小的顺序
②丙三醇、丙烷、乙二醇的沸点由高到低的顺序
③苯酚、苯甲酸、醋酸的酸性由强到弱的顺序
(提示:类比酚与醇的酸性)
III.某有机物蒸气0.1L与a LO2在一定条件下恰好燃烧,生成0.3L水蒸汽、0.1LCO2和0.1LCO(气体体积均在相同条件下测得)。
(1)a的最大值为_________,有机物的结构简式为________________。
(2)当有机物为乙二醇时,a的值为_____________。
(1)偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。Ti元素在元素周期表中的位置是;其基态原子的电子排布式为。
已知偏钛酸钡中钛元素呈最高正价,则偏钛酸钡最有可能的化学式为。
(2)在下面的电子结构中,第一电离能最小的原子可能是 (填字母)
A.ns2np3B.ns2np5C.ns2np4D.ns2np6
(3)一些药物的结构如下图所示,则关于这些物质的说法中正确的是:
A.这些物质中,盐酸伪麻黄碱,乐铂熔点较高
B.这些物质中都有手性碳原子
C.这些物质中,有共价键、离子键、配位键、极性键、非极性键、σ键、π键
D.这些物质溶于水的时候都需要破坏范德华力、氢键