今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20,且a+b+c=25;②元素Z的原子价电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z氯化物的相对分子质量之比为38︰77。回答下列问题:
(1)Z的价电子排布图为: 。
(2)X2Y2的电子式 ,该晶体中含微粒间的作用有: 。
(3)Y的最常见氢化物的VSEPR模型为 , 其中Y原子以 杂化轨道成键;Z的氯化物的分子空间构型是 ;根据原子轨道成键方式分,Z的硫化物分子中含有的键的种类及数目是 、 。
石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。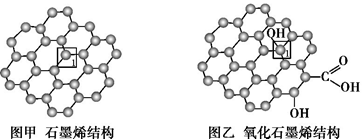
(1)图甲中,1号C与相邻C形成σ键的个数为 。
(2)图乙中,1号C的杂化方式是 ,该C与相邻C形成的键角 (填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有 (填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一 种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为 ,该材料的化学式为 。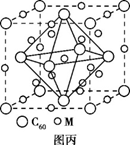
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899 |
1 757 |
14 840 |
21 000 |
| B |
738 |
1 451 |
7 733 |
10 540 |
①请根据上述信息,写出A的核外电子排布式:__________________。
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了________。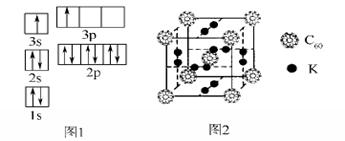
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中碳碳键的键长为154.45 pm,C60中碳碳键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由,理由:_____________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为____________。
③继C60后,科学家又合成Si60、N60,请比较C、Si、N原子电负性由大到小的顺序。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中所含π键的数目为__________。
(1)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol—1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”或“<”=)
SiCSi; SiCl4SiO2
②下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。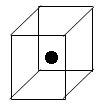
③工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温Si(s) + 4 HCl(g)该反应的反应热△H =kJ/mol.
(2)化合物Na2O的晶胞如图。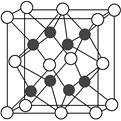
①其中O2-离子的配位数为________,
②该化合物与MgO相比,熔点较高的是________(填化学式)。
③已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
(1)自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
①请根据XeF4的结构示意图(图1)判断这个分子是(填极性分子或非极性分子)。
②XeF2晶体是一种无色晶体,图2为它的晶胞结构图。XeF2晶体属于哪种类型的晶体__________;
③一个XeF2晶胞中实际拥有XeF2_______个。
(2)新制备的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为,1 mol乙醛分子中含有的σ键的数目为。乙酸的沸点明显高于乙醛,其主要原因是。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子。
Ⅰ.(1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)==="2NO(g)" ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g)ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g)ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是___,NO分子中化学键的键能为___kJ·mol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
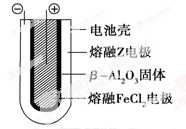
Ⅱ.熔融状态下,钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2 Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为________________;充电时,________(写物质名称)电极接电源的负极;该电池的电解质为______