(1)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol—1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”或“<”=)
SiC Si; SiCl4 SiO2
②下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。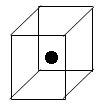
③工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温Si(s) + 4 HCl(g) 该反应的反应热△H = kJ/mol.
(2)化合物Na2O的晶胞如图。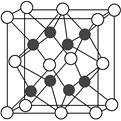
①其中O2-离子的配位数为________,
②该化合物与MgO相比,熔点较高的是________(填化学式)。
③已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。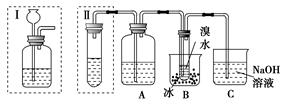
(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
已知下列物质:
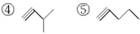
请按要求填空:
(1)写出①④的名称________、________;
(2)写出②、⑤的分子式________、________;
(3)互为同分异构体的是________。
(4)写出③与等物质的量的Br2反应的化学方程式:_______________________________。
化合物A是合成天然橡胶的单体,结构简式为CH2=C(CH3)—CH=CH2。A的一系列反应如下(部分反应条件略去):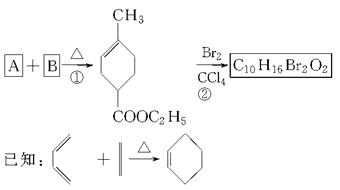
回答下列问题:
(1)A的化学名称是________;
(2)B的分子式为________;
(3)②的反应方程式为_____________________________;
(4)①和②的反应类型分别是________,________;
已知烯烃、炔烃在臭氧的作用下发生以下反应:
CH3—CH=CH—CH2—CH=CH2―→CH3CHO+OHC—CH2—CHO+HCHO
CH3—C≡C—CH2—C≡CH―→CH3COOH+HOOCCH2COOH+HCOOH
某烃分子式为C10H10,在臭氧作用下发生反应:
C10H10―→CH3COOH+3HOOC—CHO+CH3CHO
(1)C10H10分子中含有________个双键,________个三键
(2)C10H10分子结构简式为________。
有机物A满足下列条件:
①它在空气中完全燃烧的产物是CO2和H2O,且燃烧过程中产生CO2的物质的量等于消耗掉O2的物质的量,也正好和生成H2O的物质的量相等;
②质谱显示A的分子离子峰质荷比为180,分子中含有六元环;
③碳和氧原子在分子结构中都有两种不同的化学环境,A的核磁共振氢谱中有3个吸收峰。
回答下列问题:
(1)A的实验式(最简式)是________;
(2)A的分子式是________;
(3)A的结构简式是________;
(4)A有一种同分异构体B,其分子中也有六元环,所有碳原子都处于相同化学环境,其结构简式是________。