某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.(1)乙同学的观点,你认为其原理是(用离子方程式表示): 。
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是 。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。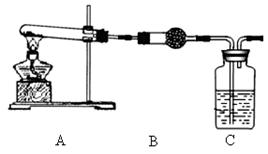
(3)B装置中试剂的化学式是 ,C装置中试剂的名称是 。
(4)能证明乙同学观点正确的预期实验现象是 。
(5)若丙同学的观点正确,用上述装置通过B、C中质量的增加来定量测定沉淀的组成,该装置存在的主要缺点是 (任答1条即可)。
(10分)中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________;装置的不足之处是;不加以改正,所求的值将 (填偏大,偏小,无影响)。
(2) 实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”);所求中和热的数值会________(填“相等”或“不相等”)。
在实验室里,某同学取一小块金属钠,做钠与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是,所发生反应的化学方程式是。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是
①________________________________________________,
②_____________________________________________________。
(3)将一小块钠投入盛有CuSO4溶液的烧杯中,不可能观察到的现象是________。
| A.有气体生成 |
| B.钠熔化成小球并在液面上游动 |
| C.烧杯底部有红色的金属铜生成 |
| D.溶液中有蓝色浑浊 |
(3)钠与CuSO4溶液反应的有关的离子反应方程式为
某同学应用如下所示装置研究物质的性质。其中气体m的主要成分是氯气,还含有少量空气和水蒸气。请回答下列问题: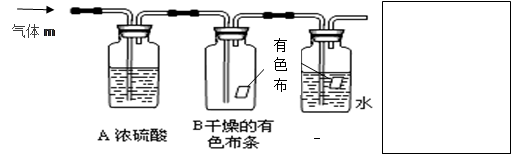
(1)浓硫酸的作用是_______________。
(2)B中观察到的实验现象是。
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请用离子方程式表达原理并画出装置图(填在上图内),
实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为g,要完成本实验该同学应称出g NaOH。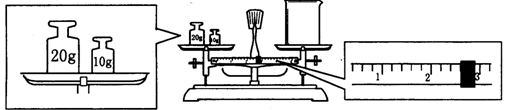
(3)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是__________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞摇匀,静置后,液面低于刻度线,再加水至刻度线。
(14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且半分钟不变化,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
(1)锥形瓶中的溶液从_____色变为_____色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注视_________;
(3)该小组在步骤①中的错误是____,由此造成的测定结果_____(填偏高、偏低或无影响);
(4)步骤②缺少的操作是__________;
(5)如图,是某次滴定时滴定管中的液面,其读数为mL
(6)根据下列数据:
| 滴定次数 |
待测液体(mL) |
标准盐酸体积(mL) |
|
| 滴定前读(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
| 第三次 |
25.00 |
0.80 |
23.10 |
请选用合理的数据计算待测烧碱溶液的浓度为_______mol/L
(7)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数